Les photos sont une gracieuseté de l'auteur, sauf indication contraire.
Importance pour les agriculteurs
Cette Note Technique donne un aperçu des plantes parasites d’importance agricole en Afrique. Les herbes parasites provoquent un stress de sécheresse et un retard de croissance au niveau des cultures. Les plantes affectées comprennent les céréales (par exemple, le sorgho [Sorgum bicolor] et le maïs [Zea mays]), ainsi que les légumineuses à grains (par exemple, le niébé [Vigna unguiculata]) dont les agriculteurs dépendent pour leur nourriture. Les dégâts causés à ces cultures et à d’autres cultures sont généralement aggravés par la faible fertilité du sol et le stress de sécheresse, conditions auxquelles de nombreux petits exploitants africains sont confrontés. Les herbes parasites peuvent entraîner de graves pertes de rendement, ce qui fait d’elles un obstacle important à la sécurité alimentaire dans de nombreuses régions.
Biologie et botanique
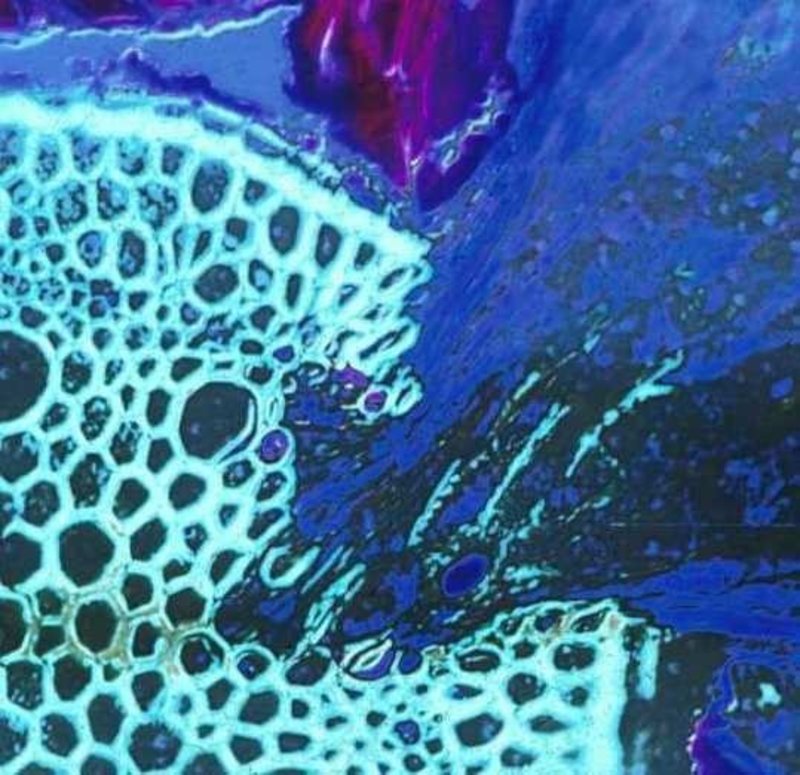
Figure 1. Un parasite racinaire (Krameria lanceolata), la moitié droite, envahissant une racine d'herbe (Aristida sp.), La moitié gauche de l'image. Le tissu haustorial est bleu foncé et le tissu vasculaire de l'hôte est vert clair. Les zones décolorées dans les zones envahies du tissu vasculaire de l'hôte indiquent les endroits où l'activité enzymatique du parasite a dégradé les cellules du xylème.
Bien que les plantes parasites soient souvent considérées comme de mauvaises herbes, elles font partie d'une association de plantes extrêmement uniques. Une compréhension de leur biologie est essentielle pour le contrôle et la gestion des plantes parasites.
Les plantes parasites sont incroyablement spécialisées et ont des adaptations remarquables. Elles comprennent des plantes herbacées, des plantes grimpantes, des arbustes et des arbres. Certaines semblent anodines, sans aucune preuve externe de leur nature parasitaire. D'autres manquent de feuilles et de tiges, n'existant que dans le corps d'autres plantes. Les stratégies de reproduction des plantes parasites varient également de façon considérable, en partant des fleurs minuscules (1 mm) de certains guis jusqu’aux fleurs d’un mètre de diamètre de Rafflesia – la plus grande fleur au monde.
Cependant, toutes les plantes parasites ont en commun un haustorium (figures 1 et 6). L’haustorium est le pont morphologique et physiologique entre l’hôte et le parasite. C'est le conduit pour les matériaux qui peuvent passer de l'hôte au parasite ou du parasite à l'hôte. Ainsi, tandis que les mauvaises herbes non parasitaires sont en concurrence avec les plantes cultivées pour l’eau et les éléments nutritifs du sol, les herbes parasites obtiennent ces ressources directement des plantes hôtes.
Catégories d’herbes parasites
Les herbes parasites peuvent être distinguées par la présence ou l'absence de chlorophylle. Celles qui produisent de la chlorophylle (et ont donc une certaine activité photosynthétique) sont appelés hémiparasites (également appelés semi-parasites). Celles qui manquent de chlorophylle (et ne sont donc pas vertes et dépendent totalement de leur hôte pour la nutrition et l’eau) sont appelées holoparasites.
Une autre distinction entre les parasites concerne leur mode de germination. Les parasites obligatoires nécessitent un hôte avant de pouvoir germer et amorcer un haustorium. Les parasites facultatifs, en revanche, peuvent germer sans hôte. Dans des conditions de forte fertilisation, certains parasites facultatifs peuvent même mûrir sans hôte.
De façon intuitive, il semble que les herbes parasites les plus incommodantes soient les holoparasites. Et en effet, les holoparasites du genre Orobanche sont des agents pathogènes bien connus de diverses cultures. Mais en Afrique, les herbes parasites les plus incommodantes sont les herbes-sorcières, qui sont des hémiparasites obligatoires du genre Striga.
Certaines plantes parasites attaquent les tiges, tandis que d'autres se limitent aux racines. Celles-ci sont simplement appelées respectivement parasites des tiges et parasites des racines. Le tableau 1 répertorie les plantes parasitaires de tiges et de racines rencontrées en Afrique.
| Tableau 1. Principaux groupes de plantes parasites d'importance économique en Afrique | ||||
|---|---|---|---|---|
| Nom commun | Genre | Famille | Principales plantes-hôtes | Obligatoire/Facultatif/Holo/Hemi |
| Parasites de la tige | ||||
|
Guis |
Différents |
Loranthaceae, Viscaceae |
Goyavier, hévéa, agrumes |
Hémiparasites obligatoires |
|
Love vine |
Cassytha |
Lauraceae |
Manguier, anacardier |
Hémiparasites obligatoires |
|
Cuscutes |
Cuscuta |
Convolvulaceae |
Lucerne, carottes, autres légumes, agrumes |
Holoparasites obligatoires |
| Parasites des racine | ||||
|
Vampire weed |
Rhamphicarpa |
Orobanchaceae |
Riz |
Hémiparasite facultatif |
|
Herbes-sorcières |
Striga |
Orobanchaceae |
Sorgho, maïs, mil, canne à sucre, fonio, riz; niébé, tabac, tef |
Hémiparasites obligatoires |
|
Herbe-sorcière jaune |
Alectra |
Orobanchaceae |
Niébé, pois Bambara, tournesol |
Hémiparasite obligatoire |
|
Orobranches |
Orobanche |
Orobanchaceae |
Vaste gamme de legumes, tabac, tournesol |
Holoparasites obligatoires |
De brèves descriptions des herbes parasites importantes sont faites ci-dessous. Elles sont mentionnées dans le même ordre que dans le tableau 1.
Les parasites de la tige
Les guis

Figure 2. Tapinanthus bangwensis parasitant la goyave près d'Abu Naama, au Soudan. La structure globulaire près du centre de la photo est l'endroit où le parasite est attaché à l'arbre. Les plus petites feuilles sont celles du parasite.
Les guis sont des parasites arbustifs et obligatoires qui vivent dans les arbres et les buissons. L'Afrique possède une grande diversité de guis, avec près de 300 espèces (Polhill et Wiens, 2000). Quelques espèces revêtent une importance commerciale. Par exemple, l’hévéa (Hevea brasiliensis) en Afrique de l’Ouest est attaqué par le gui Phragmanthera capitata. Le même gui peut infecter le colatier (Cola nitida). Au Soudan, le goyavier (Psidium guajava) est infecté par Tapinanthus bangwensis (Figure 2); de fortes infestations peuvent tuer l'arbre. T. bangwensis s'attaque également aux agrumes. De nombreux autres guis sont des ravageurs en Afrique et même des espèces de gui jusque-là bénignes peuvent potentiellement attaquer des cultures commerciales arbustives.
La lutte contre le gui est difficile en raison de la connexion intime ressemblant à une greffe entre l'hôte et le parasite. Les herbicides ont engrangé un certain succès. L'élimination manuelle du gui est la plus efficace, mais elle est coûteuse en temps et en main-d'œuvre.
Love Vine

Figure 3. Cassytha filiformis sur la noix de cajou en Guinée Conakry (à droite). Fruits de love vine (en haut à gauche) et les fleurs (en bas à gauche).
Love vine est un nom commun anglais de Cassytha filiformis, une vigne herbacée très grimpante répandue en Afrique mais plus répandue dans les régions côtières. Les plantes manquent de feuilles; une love vine consiste en une tige qui porte de minuscules fleurs blanches et des fruits blancs avec une seule graine noire (Figure 3). La love vine s'enroule autour de la plante hôte et pénètre avec des haustoria en forme de cheville, formant souvent de grandes masses enchevêtrées. Les tiges sont vertes et photosynthétiques, mais la chlorophylle est parfois masquée par un pigment orange. Bien qu'elle puisse amorcer la photosynthèse, la plante ne peut pas se développer sans parasiter un hôte. La love vine est régulièrement confondu avec une espèce de cuscute (Cuscuta sp.); elle se distingue de cette dernière par la présence de poils courts qui sont évidents lorsque la tige est observée avec une loupe de 10X.
Pratiquement toutes les plantes ligneuses peuvent servir d’hôte à la love vine. Le manguier (Mangifera indica), hôte commun en Afrique de l’Ouest, semble être endommagée par une combinaison d’étouffement, de carence en matières nutritives et de perte d’humidité. Parmi les autres hôtes figurent l’anacardier (Anacardium occidentale) (Figure 3) et l’avocatier (Persea americana). La lutte se limite principalement à l’élimination physique des branches d’arbres auxquelles sont attachées des tiges de vigne vivantes. Taillez les branches touchées dès que possible afin d'éviter toute croissance ultérieure de la love vine et la production de graines (Nelson 2008). Brûler les déchets d’élagage empêche la germination des graines de vigne associées aux tiges indissociables.
Les cuscutes

Figure 4. Cuscuta pedicellata endommageant une parcelle de roquette (Eruca sativa) à Wau au Soudan du Sud (à droite). Les fleurs des cuscutes et les tiges délicates sont représentées à gauche.
Les espèces de cuscute (Cuscuta spp.) sont répandues dans toute l’Afrique et peuvent causer de graves problèmes dans les champs agricoles. Les cuscutes sont des holoparasites obligatoires (bien que certaines espèces contiennent des traces de chlorophylle). Les plantes ne sont composées que de tiges! Aucune feuille ni racine ne se forment. Les cuscutes n'ont pas de poils, ce qui les distingue clairement des espèces Cassytha. Les fleurs de cuscute sont petites et blanches et produisent une capsule papyracée contenant jusqu'à quatre graines. Dans la plupart des conditions, l'enchevêtrement dense de tiges disparaît après un an.
La cuscute est hébergée par un large éventail d'espèces végétales, comme l'indique la capacité des plantes de cuscute à parasiter une diversité de plantes à la fois. La cuscute attaque de nombreuses cultures de plein champ, notamment la carotte (Daucus carota), la corète potagère (Corchorus olitorius), la roquette (Eruca sativa, figure 4) et la tomate (Solanum lycopersicum). La cuscute affecte également des plantes ligneuses ornementales telles que les bougainvillées (Bougainvillea spp., Figure 5). À l'exception de l'oignon (Allium cepa), il n'existe aucun cas documenté de cuscute parasitant des monocotylédones; cela signifie que les cultures céréalières telles que le maïs et le sorgho ne sont pas des hôtes pour la cuscute.

Figure 5. Vue commune dans certaines régions d’Afrique de l’Est. Cuscuta kilimanjari parasitant une haie de bougainvilliers à Arusha, en Tanzanie. La photo à droite montre des fleurs et des tiges; Cette photo est de Roger Ronini, utilisée avec permission.
L’assainissement est le meilleur moyen de réduire la propagation et l’infestation de la cuscute. Éviter la contamination des semences de cultures avec des graines de cuscute. Les graines de cuscute ont une surface rugueuse; si les graines de la culture passent à travers des rouleaux de feutre, les graines de la cuscute colleront au matériau de feutre et seront ainsi séparées des graines de la plante. Enlevez la cuscute (à la main ou à l'aide d'herbicides) lorsqu'elle se trouve dans les champs, les bordures de champs et sur de mauvaises herbes infestées. Dawson et al. (1999) passent en revue les recommandations concernant les herbicides, les autres stratégies de lutte et la biologie générale des cuscutes. (1994), Kaiser et al. (2015) et Sarić-Krsmanović et Vrbničanin (2015).
Les parasites des racines
L'herbe vampire

Figure 6. Rhamphicarpa fistulosa parasitant le riz près de Bouaké, en Côte d'Ivoire. La suppression du riz est plus évidente au centre et au bas de la photo principale. sur la droite. Les photos à gauche montrent des fleurs s'ouvrant au crépuscule (en haut) et des racines de riz avec Rhamphicarpa haustoria en flèche (en bas; une échelle millimétrique est située derrière les racines).
L’herbe vampire (Rhamphicarpa fistulosa), hémiparasite facultatif, est différente des parasites des racines décrits ci-dessous, qui appartiennent également à la famille des Orobanchaceae mais qui sont des parasites obligatoires. L’herbe vampire est surtout connue pour ses dégâts causés au riz, car elle pousse dans les zones humides. Elle peut également attaquer d'autres membres de la famille des graminées.
L’herbe vampire est une plante annuelle à nombreuses branches et à feuilles divisées. Les fleurs sont blanches et ouvertes la nuit, ce qui est caractéristique des fleurs pollinisées par les papillons de nuit (Figure 6). Le fruit forme une capsule à bec contenant jusqu'à deux cent petites graines. L’herbe vampire parasite les herbes depuis de nombreuses années, mais ce n’est que récemment que ses dégâts et son impact économique ont été pris en compte (Rodenburg et al. 2014). Afin de prévenir au mieux les infestations, utilisez des mesures sanitaires similaires à celles décrites pour la cuscute. Les pratiques de gestion, dont traitent Rodenburg et al. (2014), comprennent le désherbage à la main, l'amendement du sol avec de l'engrais ou des balles de riz et des submersions périodiques ou continues.
Les herbes-sorcieres
Dégâts sur les cultures et cycle de vie des cultures
Les herbes-sorcières (Striga spp. et Alectra spp.) sont les herbes parasites les plus nuisibles, voire les plus destructrices de toutes les mauvaises herbes, en particulier en Afrique subsaharienne. Les dégâts causés par les herbes-sorcières sont influencés par une multitude de facteurs, ce qui rend difficile toute estimation précise de la perte de récolte. Gebisa Ejeta (2007), chercheur de renom sur la Striga, a exprimé la gravité du problème de la manière suivante:
«Les pays infestés par la Striga il y a seulement 25 ans affichent maintenant de lourdes pertes annuelles de rendement. Selon des estimations approximatives, près de 300 millions de personnes en Afrique subsaharienne sont touchées par la Striga, et jusqu'à 50 millions d'hectares de terres cultivées sur le continent présentent des degrés variables d'infestation par la Striga.»
Du point de vue de la lutte, il est important de souligner que ce ne sont pas des mauvaises herbes typiques. La réduction du rendement des cultures n’est pas due à la concurrence ni à l’allélopathie. En fait, avec l’herbe-sorcière, les dégâts se produisent avant même que le parasite ne soit détecté dans un champ. C’est pourquoi il est important de comprendre la biologie de l’asphyxie. Connaître le cycle de vie aide les agriculteurs et les praticiens à identifier les points d'intervention possibles pour lutter contre le parasite.

Figure 7. Cycle de vie général des herbes-sorcières. Photo A de semences par un laboratoire de graines d'Agriculture Canada. Diagramme (à droite) adapté de: Joel et al. (2007); Biologie et lutte contre les parasites de parasites racinaires envahissantes (utilisé avec permission).
Une différence frappante entre le comportement des herbes-sorcières et celui des mauvaises herbes non parasites est que les dégâts subis par l’hôte se produisent dès que la connexion vasculaire est établie. Le parasite, souterrain et dépourvu de chlorophylle, élimine les éléments nutritifs de la plante hôte. Cependant, le mouvement se fait dans les deux sens et le parasite produit et transfère des composés qui modifient l’architecture de la plante hôte. Par exemple, lorsque S. asiatica attaque le maïs, le plant de maïs produit plus de racines, offrant ainsi des sites supplémentaires pour le parasitisme. La plante parasite peut également amener la plante hôte à produire des inhibiteurs de croissance tels que le farnésol et l'acide abscissique.Les herbes-sorcières ont un cycle de vie complexe et bien adapté aux régions tropicales semi-arides (Figure 7). Les graines sont minuscules (7A, 7F) et hautement spécialisées. Elles ne germent pas à moins d'être conditionnées par exposition à l'humidité à une température requise variant selon les espèces. Une fois conditionnées contre l’humidité, les graines peuvent réagir à un stimulus chimique de l'hôte qui déclenche la germination (7B). La communication élégante entre l'hôte et le parasite a fait l'objet de nombreuses recherches récentes et a permis de découvrir une classe d'hormones végétales appelées strigolactones (Matusova et al. 2005). Ces hormones sont libérées dans le sol par les racines des plantes hôtes, ce qui induit la germination des graines. La graine de l’herbe-sorcière nouvellement germée amorce un haustorium avec lequel elle s'attache à l'hôte et la pénètre (7B, 7C). Une fois la connexion vasculaire établie, la plantule se développe (7D).
Bien que l’herbe-sorcière soit encore sous terre, l’agriculteur observe un retard de croissance du sorgho ou d’autres céréales, mais ignore souvent la présence de la plante parasite. Au moment où l’herbe-sorcière émerge, les dégâts causés à l'hôte sont souvent irréversibles. Le parasite émerge pour fleurir (7E) et pour produire des graines (7F); bien qu’il contienne de la chlorophylle, il ne produit pas assez de photosynthèse pour se maintenir.
La capacité de l’herbe-sorcière à produire des milliers de graines rend son élimination du champ extrêmement difficile. Une plante peut produire des milliers et des milliers de graines ressemblant à de la poussière. On sait que ces graines persistent dans le sol pendant une dizaine d'années. Selon certaines rapports (Parker et Riches, 1993), les graines survivent dans le sol jusqu’à vingt ans.
Des mesures de lutte
Le désherbage n'entrave guère les dégâts causés par l'hôte, mais peut aider à réduire les semences dans la banque de semences du sol. Pour être efficaces, les herbes-sorcières doivent être arrachées dès que les plantes sortent de terre. L'élimination précoce des plantes de la striga est nécessaire pour empêcher la production de graines. N’utilisez pas l’herbe-sorcière comme fourrage, car les graines passent à travers les animaux sans perdre leur viabilité. Comme la plupart des mauvaises herbes, l’herbe-sorcière se propage en grande partie par l’activité humaine – en particulier la plantation de céréales contaminées par des graines d’herbes-sorcières
De nombreuses stratégies de lutte différentes ont été développées. Certaines d'entre elles sont décrites ci-dessous, en suivant le schéma général d'une étude récente et utile réalisée par Samejima et Sugimoto (2018). Un article plus ancien réalisé par Joel et al. (2007) fournit un examen plus approfondi et contient des informations sur l'utilisation d'herbicides pour lutter contre les herbes parasites.
Les mesures de contrôle actuelles peuvent être divisées en cinq catégories: les variétés d’hôtes résistantes et tolérantes, les pratiques culturales, les techniques microbiologiques, la lutte chimique, et l’extinction de gènes induite par l'hôte. Dans ce document, l’analyse se limite aux deux premières catégories, car elles sont les plus transférables aux petits agriculteurs aux ressources limitées.
Variétés d’hôtes résistantes et tolérantes. Il est important de comprendre la distinction entre les hôtes résistants et ceux tolérants. Les variétés résistantes des plantes hôtes ont des adaptations qui les aident à se protéger de la plante parasite à un moment donné de son cycle de vie. En revanche, les variétés des plantes hôtes tolérantes sont capables de produire un rendement acceptable malgré une infestation modérée par l’herbe-sorcière.
Il y a environ quarante ans, les scientifiques ont découvert que certaines variétés de sorgho produisaient moins de stimulant de germination que d'autres (Belay, 2018). Ces recherches ont mené à de vastes programmes de sélection à l'ICRISAT (Institut international de recherche sur les cultures des zones tropicales semi-arides) et à l'IITA (Institut international d'agriculture tropicale) pour exploiter ces gènes. D'autres variétés offrent une résistance mécanique et biochimique à l'invasion et à l'établissement de parasites. La disponibilité de semences résistantes au sorgho varie d'un pays à l'autre. Recherchez les publications de l'ICRISAT et d'autres programmes de sélection de cultures dans les magasins / dépôts de semences.
Les petits exploitants peuvent mieux s’attaquer au problème de l’herbe-sorcière en plantant des variétés de cultures résistantes et / ou tolérantes, associées à des approches culturales sans coût ou peu coûteuses (comme celles décrites ci-dessous). Au départ, un agriculteur pourrait devoir acheter des semences de la variété de culture résistante ou tolérante, mais pourrait ensuite en bénéficier pendant des années, en supposant que les semences de la variété de culture puissent être conservées (c'est-à-dire qu'elles soient à pollinisation libre), qu'elles maintiennent la résistance ou la tolérance, et qu’il s’agisse d’une plante alimentaire fort appréciée.
Pratiques culturales. La culture itinérante est une pratique culturale utilisée au Soudan et dans d'autres pays peu peuplés et disposant de terres disponibles. Le principe est simple: un champ est cultivé jusqu'à ce que le niveau de l’herbe-sorcière réduise considérablement le rendement des cultures, puis le champ est abandonné pendant plusieurs années. De nombreuses herbes indigènes et certaines autres plantes peuvent faire germer l’herbe-sorcière sans soutenir son développement. Pendant plusieurs années, le champ subit une sorte d’effet d’assainissement, car les graines de l’herbe-sorcière germent puis meurent. La culture itinérante peut ne pas être une option dans les zones à forte densité de population avec des contraintes de superficie.
La méthode de «poussée-traction» est une pratique culturale récente et prometteuse (voir, par exemple, Murage et al. 2015). Cette technique a été utilisée principalement avec le maïs, mais est maintenant utilisée avec d'autres céréales. Généralement, un agriculteur intercale le maïs avec une espèce de desmodium (Desmodium spp.), qui est une légumineuse. Le desmodium libère un produit chimique qui repousse les insectes parasites foreurs de tige, « repoussant » les insectes du maïs. Autour du champ de maïs, l'agriculteur plante le napier (Pennisetum purpureum), qui attire les foreurs de tige et les « éloigne » du maïs. En plus de repousser les foreurs de tige, le desmodium réduit également la quantité d’herbe-sorcière dans le maïs, en stimulant la germination des graines d’herbe-sorcière mais en inhibant la croissance de l’haustorium de la Striga (Khan et al. 2002); c'est un exemple élégant de culture piège qui fait germer la striga mais qui n'est pas parasitée. On a constaté que les rendements en grains augmentaient avec l'utilisation de la technologie de la «poussée-traction» (Murage et al. 2015). Étant donné que le desmodium est une plante vivace, il permet la suppression à long terme de l’herbe-sorcière.
D'autres légumineuses, à part le desmodium, ne contiennent pas d'herbe-sorcière et la suppriment de diverses manières (par exemple, en induisant une germination suicidaire et / ou en étouffant les herbes parasites). Le niébé, la crotalaire (Crotalaria ochroleuca) et le gram vert (Vigna radiata) se sont avérés efficaces pour réduire l’asphyxie au Kenya (Khan et al. 2007).
Les méthodes de lutte culturales susmentionnées devraient être associées à des pratiques améliorant la fertilité des sols et la matière organique. La libération rapide d'azote dans le sol, provenant de sources organiques ou inorganiques, a été corrélée à une infestation réduite par l'herbe-sorcière. Ayongwa (2011) a suggéré de microdoser un engrais minéral avec des apports de matières organiques de haute qualité (c'est-à-dire des matières organiques avec un faible rapport carbone/azote). Le microdosage est l'application de petites quantités d'engrais à proximité de chaque plante cultivée. Cette pratique réduit considérablement la quantité d'engrais nécessaire par rapport au traitement d'un champ entier. (Le numéro 84 des Notes de Développement de ECHO décrit le microdosage avec des bouchons de bouteille.) La santé du sol étant essentielle pour réduire au minimum l'herbe-sorcière, il peut être bénéfique pour les agriculteurs de faire pousser des céréales sensibles sur une superficie suffisamment petite pour pouvoir la gérer, en consacrant l'espace restant aux cultures qui ne sont pas des hôtes pour l’herbe-sorcière.
Enquête sur les espèces de striga d'importance agronomique en Afrique
La striga est essentiellement un genre africain, et l'Afrique contient la plus grande diversité d'espèces de striga. Une monographie de Mohamed et al. (2001) constitue la base de la taxonomie et de la distribution décrites ci-dessous.
Striga hermonthica (Figure 8)

Figure 8. Striga hermonthica à Kadugli, au Soudan. La culture de sorgho à gauche est presque détruite
Atteignant une hauteur de 2 m, S. hermonthica est la plus grande et sans doute la plus destructrice des trois principales espèces de sorgho (S. hermonthica, S. asiatica et S. gesnerioides). On la trouve principalement en Afrique de l'Ouest et dans certaines parties de l'Afrique de l'Est, mais il semble qu'elle se soit étendue au nord de la Namibie. S. hermonthica attaque pratiquement toutes les cultures céréalières, mais est signalée moins souvent sur les plants de riz.
Striga aspera (Figure 9)

Figure 9. Striga aspera sur le fonio (grande photo) et sur le riz (photo encadrée à gauche) en Guinée (Conakry). La photo en bas à droite montre la différence de structure de la fleur entre S. hermonthica et S. aspera.
S. hermonthica est souvent confondu avec S. aspera, qui lui ressemble mais qui est une espèce distincte (Figure 9). Bien que moins nuisible que S. hermonthica, S. aspera provoque encore de lourdes pertes de récoltes dans certaines parties de l'Afrique de l'Ouest, où elle peut constituer un sérieux problème pour le fonio (Digitaria exilis) et la canne à sucre. On sait également qu’elle s’attaque sorgho et au riz. Il n’existe pas beaucoup de données sur S. aspera, probablement parce qu’on la confond avec S. hermonthica.
Striga asiatica (Figure 10)

Figure 10. Striga asiatica sur le mil. Les fleurs rouge vif distinguent cette espèce des autres herbes-sorcières d'importance agronomique.
S. asiatica est une petite plante à nombreuses branches et à fleurs de couleur rouge pourpre (rarement jaune). L'espèce d’herbe-sorcière la plus tempérée, elle peut survivre à de plus hautes altitudes en Afrique. S. asiatica a été introduite en Caroline du Nord et du Sud (aux États-Unis) dans les années 1950; des dégâts considérables ont été constatés sur le maïs, ce qui a incité le gouvernement à réagir et à lancer des recherches novatrices sur la biologie de l’herbe-sorcière. En conséquence, les scientifiques ont découvert le strigol, un composé maintenant connu pour être l'une des strigolactones. Le strigol est dérivé des racines de coton (Gossypium sp.), qui n’est pas un hôte pour l’herbe-sorcière; cette découverte a donc conduit à la recherche de composés dans d’autres cultures-pièges qui induiraient la germination mais ne soutiendraient pas l’herbe-sorcière.
En Afrique australe, S. asiatica limite souvent considérablement la culture du maïs, du mil, du riz et de la canne à sucre. Elle peut constituer un problème pour le sorgho en Afrique centrale et est également présente en Inde et dans d'autres parties de l'Asie du Sud.
Striga gesnerioides (Figure 11)

Figure 11. Striga gesnerioides. Les deux photos à gauche montrent des fleurs de S. gesnerioides sur le niébé (en bas) et sur une espèce d'Euphorbia (en haut), illustrant la variation de la fleur entre les formes parasitant différents hôtes. Les photos plus grandes montrent S. gesnerioides sur le niébé au Bénin (photo du milieu) et au Mali (photo de droite).
Contrairement à d’autres herbes-sorcières, S. gesnerioides s'attaque aux dicotylédones plutôt qu'aux cultures céréalières. C'est un facteur important dans la réduction du rendement du niébé (Vigna unguiculata) en Afrique de l'Ouest, mais il peut également attaquer le tabac et d'autres légumineuses telles que l'arachide bambara (Vigna subterranea). S. gesnerioides est la plus répandue et la plus variable de toutes les herbes-sorcières africaines. On la trouve du Maroc au Soudan et de l'Éthiopie jusqu'en Namibie et en Afrique du Sud. Sur les cultures, les plantes de S. gesnerioides ont de nombreuses branches qui sont souvent teintées de pourpre. Les fleurs ont tendance à être petites avec des corolles mauves ou blanchâtres. Comme le montre la figure 11, la morphologie de cette espèce varie considérablement.
Striga forbesii (Figure 12)

Figure 12. Striga forbesii sur la canne à sucre en Somalie (à gauche) et sur le maïs au Zimbabwe (en bas à droite). La photo en haut à droite montre les fleurs de S. forbesii plus en détail.
Les trois plus grandes (S. hermonthica, S. asiatica et S. gesnerioides) sont les herbes-sorcières les plus nuisibles. En effet, elles sont le facteur le plus grave des pertes de récoltes dans certaines régions. Cependant, S. forbesii pose un problème pour le maïs au Zimbabwe et elle cause des dégâts considérables, compte tenu de la taille de l'hôte, pour la canne à sucre en Somalie. C'est une plante de taille moyenne atteignant 1,5 m de haut avec des corolles roses distinctes.
Alectra vogelii (Figure 13)

Figure 13. Alectra vogelii sur le niébé au Nigéria (à droite) et Alectra sessiliflora en Namibie (à gauche).
Les espèces du genre Alectra sont souvent désignées sous le nom d’herbes-sorcières jaune; Ce descripteur est imprécis car certaines espèces de striga ont des fleurs jaunes et toutes les espèces d’Alectra n’ont pas de fleurs jaunes - bien que les espèces d’Alectra qui sont des ravageurs de l’agriculture aient des fleurs jaunes. Les plantes du genre Alectra sont petites (jusqu'à 0,5 m), généralement avec de nombreuses branches et des feuilles très réduites ressemblant à des écailles. Les fleurs produisent des capsules contenant un grand nombre de graines ressemblant à de la poussière.
Comme les autres espèces d’herbe-sorcière, les espèces d'Alectra sont des hémi-parasites obligatoires nécessitant un stimulant de l'hôte pour germer. On les trouve dans toute l'Afrique tropicale, où elles parasitent le niébé et les arachides, ainsi que le tournesol (Helianthus annuus); Contrairement à la plupart des espèces de Striga, les espèces d'Alectra attaquent diverses familles. Les méthodes de contrôle des espèces d’Alectra sont fondamentalement les mêmes que celles des espèces de Striga.
Les orobranches
Les orobranches comprennent deux genres étroitement liés, Orobanche et Phelipanche. Contrairement aux autres parasites racinaires que nous avons étudiés, ces plantes sont totalement dépourvues de chlorophylle. Dans d’autres aspects de leur biologie, elles ressemblent beaucoup aux herbes-sorcières (figure 7), produisant un très grand nombre de graines qui peuvent survivre pendant au moins une décennie dans le sol. Cela signifie que bon nombre des mesures de lutte utilisées contre l’herbe-sorcière peuvent également s’appliquer aux orobranches. Le nom commun de ces plantes provient d'une espèce qui s'attaque au Genêt à balais (Cytisus scoparius), une légumineuse originaire d'Europe.
La diversité des orobranches est centrée dans la région méditerranéenne plutôt que sous les tropiques. Elles sont donc en grande partie tempérées dans leur distribution et peuvent survivre à des températures plus froides que de nombreuses autres plantes parasites. En Afrique, leur plus grande importance se situe dans la vallée du Nil et au Maghreb, bien qu'elles puissent pousser ailleurs à des altitudes plus élevées. Des méthodes de lutte et des détails sur la biologie de ces parasites fascinants figurent dans le recueil publié par Joel et al. (2013).
Orobanche crenata (Figure 14)

Figure 14. Orobanche crenata sur la fève en Ethiopie. Les plantes en pot montrent l’impact d’une seule orobranche sur la fève. D'après des recherches menées par l'auteur à la Weed Research Organization, Oxford.
C'est un grand parasite robuste atteignant 2 m de haut, aux fleurs voyantes et parfumées. Elle est une contrainte majeure pour la culture de la fève (Vicia faba) en Éthiopie et dans la vallée du Nil. Certaines variétés de fèves résistantes ont été développées. Elle peut également constituer un problème sérieux pour la carotte et plusieurs autres cultures.
Orobanche ramosa (Figure 15)

Figure 15. Orobanche ramosa sur le tabac en Bulgarie (à gauche) et sur la tomate au Soudan (à droite). Remarquez les feuilles fanées des tomates et du tabac. Dans des infestations aussi importantes que celle de la photo de droite, les fruits de la tomate ne se développent pas; au lieu de cela, ils pourrissent.
Également connu sous le nom de Phelipanche ramosa, cette orobranche se trouve maintenant dans le monde entier et est considéré comme l'une des mauvaises herbes les plus nuisibles à l'échelle mondiale. Son éventail d'hôtes est remarquablement large et elle constitue un problème important pour les tomates, les pommes de terre, les aubergines, le tabac, plusieurs légumineuses, les moutardes, etc. En Afrique, elle affecte principalement les légumes d’hiver, comme les tomates d’hiver au Soudan, illustrées à la figure 15.
Orobanche cumana (Figure 16)

Figure 16. Gros plan des fleurs d'Orobanche cumana (à gauche) et d'O. cumana sur un tournesol en Bulgarie (à droite).
O. cumana est l’un des problèmes les plus graves de la culture du tournesol en Europe orientale; la plante peut aussi attaquer le tabac, l'aubergine et la tomate. Bien que peu répandue en Afrique, O. cumana serait présente sur des cultures en Afrique du Nord et en Éthiopie et pourrait devenir une menace pour le tournesol cultivé à haute altitude dans certaines régions d'Afrique.
Résumé des options de lutte
Un plan de gestion détaillé pour chaque espèce de mauvaise herbe parasite dépasse le cadre de ce document. Cependant, les options de lutte présentées précédemment dans la présente note technique donnent lieu à plusieurs principes généraux et pratiques résumés dans le tableau 2. Aucune pratique ne fonctionnera dans tous les contextes ni pour toutes les espèces de d’herbes parasites. Les stratégies les plus efficaces sont susceptibles de contenir un mélange de pratiques que les agriculteurs peuvent facilement mettre en œuvre.
| Tableau 2. Pratiques contribuant à prévenir ou à réduire l'incidence des herbes parasites dans les champs des agriculteurs. | |||
|---|---|---|---|
|
Pratique* |
Principe de lutte |
Avantage(s) |
Contraintes potentielles** |
| Pratiques qui empêchent la propagation des herbes parasites à de nouvelles zones | |||
|
Maintenir la santé du sol |
La présence d’herbes parasites est souvent un symptôme de la pauvreté des sols |
Augmentation des rendements et moins d’herbes parasites |
Manque d'amendements du sol disponibles et coût des intrants |
|
Planter des cultures non hôtes |
Les cultures non hôtes ne laissent aucune source de nourriture aux herbes parasites |
Souvent, des cultures alternatives peuvent être cultivées |
Les agriculteurs n’acceptent pas les cultures de remplacement |
|
Désinfectez les semences avant de les semer |
Si les graines sont propres, aucune nouvelle graine de mauvaise herbe ne sera plantée |
Le concept est simple |
Les agriculteurs peuvent ne pas avoir les moyens de séparer les semences de cultures et de semences |
|
Empêcher le bétail de paître dans les champs contenant des herbes parasites |
Cette pratique empêche la propagation des graines de mauvaises herbes par le fumier animal |
Le concept est simple |
Les clôtures coûtent chères; des considérations culturales peuvent nécessiter un accord à l'échelle de la communauté |
| Pratiques réduisant l'impact et la propagation des herbes parasites déjà présentes | |||
|
Désherber avec la main |
Empêche le développement de nouvelles graines de mauvaises herbes |
Le nombre de graines de mauvaises herbes dans le sol diminue avec le temps |
Nécessite du travail; la question du temps peut être critique (désherber avant que les semences ne se développent); n'atténue pas les dégâts subis par les cultures avant leur élimination |
|
Jachère ou pratique de culture itinérante |
Les graines d’herbes parasites se décomposent naturellement dans un sol en jachère |
Le concept est simple |
Les agriculteurs n'ont peut-être pas assez de terres pour laisser des terres en jachère |
|
Variétés de plantes résistantes ou tolérantes |
Ces plantes cultivées résistent au parasitisme ou sont capables de résister au parasitisme |
Cette pratique est relativement facile à mettre en œuvre |
Les graines peuvent ne pas être disponibles ou peuvent être trop chères; la résistance peut varier dans le temps et dans diverses conditions |
|
Intégrez des cultures-pièges non hôtes comme le desmodium |
Les cultures-pièges induisent la germination de mauvaises herbes parasites, mais ne leur permettent pas de s'établir. |
Les cultures-pièges peuvent offrir d’autres avantages, tels que nourriture / fourrage |
Les graines peuvent ne pas être disponibles; selon l'emplacement, planter une culture-piège laisse moins de place pour la culture principale |
|
Améliorer la santé du sol |
La pression parasitaire des mauvaises herbes diminue généralement dans un sol fertile |
Les rendements des cultures augmentent dans un sol sain |
Approvisionnement insuffisant en amendements de sol et coût des intrants |
|
Utiliser des herbicides |
Les herbicides tuent les herbes parasites via des mécanismes qui varient en fonction de l'herbicide utilisé |
Lutte rapide contre les mauvaises herbes avec une main-d’œuvre minimale |
Coût élevé; manque de connaissances ou d'équipement de protection pour une utilisation sans danger des herbicides; effets environnementaux négatifs |
| *Cette liste n'est pas exhaustive; elle met en évidence des pratiques pouvant être mises en œuvre, sous une forme ou une autre, par la plupart des petits exploitants agricoles. Consultez la littérature pour connaître les meilleures pratiques pour des espèces d’herbes parasites spécifiques dans votre région. | |||
| **Soyez conscient de ces contraintes, mais reconnaissez également qu'il existe souvent des moyens de les surmonter. | |||
Remerciements
L’auteur reconnaît le soutien généreux de la dotation Mary Payne Hogan à l’Université Old Dominion, de la Commission Fulbright américaine, et de la subvention AID DHR 5600-G-00-1021-00 de l’USAID.
Références et lectures complémentaires
La science des plantes parasites a été lancée en 1969 par la publication de la biologie magistrale des plantes parasites de Job Kuijt (Kuijt, 1969). Depuis lors, on a assisté à l’apparition d’une série de livres sur les plantes parasites [p. Ex. Heide-Jorgensen (2008); Parker et Riches (1993); Press et Graves (1995); Joel et al. (2013)]. Nickrent et Musselman (2017) et Těšitel (2016) sont d'autres revues utiles sur les plantes parasites. Avec la création en 1978 du bulletin d'information Haustorium, édité par Parker et Musselman, la littérature actuelle sur les plantes parasitaires fait l'objet d'une revue exhaustive deux fois par an. Des exemplaires de tous les numéros du bulletin sont disponibles en ligne, ainsi que des fichiers composites qui facilitent les recherches.
Ayongwa, G.C. 2011. Understanding the Diverse Roles of Soil Organic Matter in the Cereal – Striga hermonthica Interaction [Comprendre les divers rôles de la matière organique du sol dans l'interaction céréales - Striga hermonthica]. Thèse de doctorat, Université de Wageningen, 132 p..
Belay, F. 2018. Breeding Sorghum for Striga Resistance: A Review [Production du sorgho pour la résistance à la striga : Revue]. Journal of Natural Sciences Research 8(5):1-8
Dawson, J.H., L.J. Musselman, P. Wolswinkel, and I. Dörr. 1994. Biology and Control of Cuscuta [Biologie et lutte contre Cuscuta]. Reviews of Weed Science 6:265-317.
Ejeta, G. 2007. The Striga Scourge in Africa: A Growing Pandemic [Le fléau de la striga en Afrique: une pandémie croissante]. Dans Integrating New Technologies for Striga Control, Intégration de nouvelles technologies de lutte contre la Striga], edité par G. Ejeta et J. Gressel. World Scientific Publishing pp. 3-16.
Gobenaa, D., M. Shimels, P.J. Rich, C. Ruyter-Spirab, H. Bouwmeester, S. Kanuganti, T. Mengiste, et G. Ejeta. 2017. Mutation in Sorghum LOW GERMINATION STIMULANT 1 Alters Strigolactones and Causes Striga Resistance [Mutation dans le Sorgho STIMULANT À FAIBLE GERMINATION 1 Modifie les strigolactones et provoque une résistance à la Striga]. PNAS 114(17):4471-4476.
Heide-Jørgensen, H. S. 2008. Parasitic Flowering Plants [Plantes à fleurs parasites]. Brill.
Joel, D.M., J. Herschenhorn, H. Eizenberg, R. Aly, G. Ejeta, P.J. Rich, J.K. Ransom, J. Sauerborn, and D. Rubiales. 2007. Biology et Management of Weedy Root Parasites [Biologie et lutte contre les parasites racinaires envahissants]. Horticultural Reviews 33:267-349.
Joel, D.M., J. Gressel, and L.J. Musselman, Editors. 2013. Parasitic Orobanchaceae Parasitic Mechanisms and Control Strategies [Mécanismes parasitaires et stratégies de lutte contre les orobanches parasites]. Springer.
Kaiser, B., G. Vogg, U.B. Fürst, et M. Albert. 2015. Parasitic Plants of the Genus Cuscuta and Their Interaction with Susceptible and Resistant Host Plants [Plantes parasites du genre Cuscuta et leur interaction avec des plantes hôtes sensibles et résistantes]. Frontiers in Plant Science 6:45
Khan, Z.R., A. Hassanali, W. Overholt, T.M. Khamis, A.M. Hooper, J.A. Pickett, L.H. Wadhams, et C.M. Woodcock. 2002. Control of Witchweed Striga hermonthica by Intercropping with Desmodium spp., and the Mechanism Defined as Allelopathic [Lutte contre l’herbe-sorcière Striga hermonthica par la culture intercalaire avec Desmodium spp. et le mécanisme défini comme allélopathique]. Journal of Chemical Ecology 28(9):1871-1885.
Khan, Z.R., C.A.O. Midega, A. Hassanali, J.A. Pickett, et L.J. Wadhams. 2007. Assessment of Different Legumes for the Control of Striga hermonthica in Maize and Sorghum [Évaluation de différentes légumineuses pour la lutte contre la Striga hermonthica dans le maïs et le sorgho]. Crop Science 47:728-734.
Kuijt, J. 1969. The Biology of Parasitic Flowering Plants [La biologie des plantes à fleurs parasitaires]. University of California Press.
Matusova, R., K. Rani, F.W.A. Verstappen, M.C.R. Franssen, M.H. Beale, et H.H. Bouwmeester. 2005. The Strigolactone Germination Stimulants of the Plant-Parasitic Striga and Orobanche spp. are Derived from the Carotenoid Pathway [Les stimulants de la germination des strigolactones de la plante parasite Striga et de l’orobanche spp. sont dérivés de la voie des caroténoïdes]. Plant Physiology 139:920-934.
Murage, A.W. , C.A.O. Midega, J.O. Pittchar, J.A. Pickett, et Z.R. Khan. 2015. Determinants of Adoption of Climate-Smart Push-Pull Technology for Enhanced Food Security Through Integrated Pest Management in Eastern Africa [Déterminants de l'adoption de la technologie push-pull intelligente face au climat pour améliorer la sécurité alimentaire grâce à la lutte intégrée en Afrique de l'Est]. Food Security 7(3):709-724.
Mohamed, K.I., L.J. Musselman et C.R. Riches. 2001. The Genus Striga (Scrophulariaceae) in Africa [Le genre Striga (Scrophulariaceae) en Afrique]. Annals of the Missouri Botanical Garden 88:60-103.
Nelson, S.C. 2008. Cassytha filiformis. [Maladie des plantes] (PD-42). Service de vulgarisation coopérative. Collège d'agriculture tropicale et de ressources humaines. Université de Hawaii à Mānoa.
Nickrent, D.L. et L.J. Musselman. 2017. Parasitic Plants. In chapter 17 of Plant Pathology: Concepts and Laboratory Exercises, 3rd Ed. [Plantes parasites. Dans le chapitre 17 de Plant Pathology: Concepts and Laboratory Exercises, 3e éd.], Publié par B.H. Ownley et R.N. Trigiano. CRC Press pp. 277-288.
Parker, C. et C. Riches. 1993. Parasitic Weeds of the World: Biology and Control [Herbes parasites du monde: biologie et lutte].CAB International.
Polhill, R. et D. Wiens. 2000. Mistletoes of Africa [Les guis africains]. Royal Botanic Gardens, Kew.
Press, M. et J. Graves, rédacteurs. 1995. Parasitic Plants [Plantes parasites].Springer
Rodenburg, J., J.J. Morawetz, et L. Bastiaans. 2014. Rhamphicarpa fistulosa, a Widespread Facultative Hemi-Parasitic Weed, Threatening Rice Production in Africa [Rhamphicarpa fistulosa, une grande herbe hémi-parasitaire facultative menaçant la production de riz en Afrique]. Weed Research 55(2):118-131.
Samejima, H. et Y. Sugimoto. 2018. Recent Research Progress in Combatting Root Parasitic Weeds [Progrès récents de la recherche dans la lutte contre les herbes parasites racinaires]. Biotechnology & Biotechnological Equipment 32(2):221-249.
Sarić-Krsmanović, M. et S. Vrbničanin. 2015. Field dodder-How to control it? [La cuscute des champs-Comment la combattre?] Pesticides and Phytomedicine 30(3):137-145.
Těšitel, J. 2016. Functional Biology of Parasitic Plants [Biologie fonctionnelle des plantes parasites]. . Plant Ecology and Evolution 149(1):5-20.
Citer cet article comme:
Musselmen, L. 2019. Les plantes parasites dans l'agriculture africaine. Note Technique no 94.