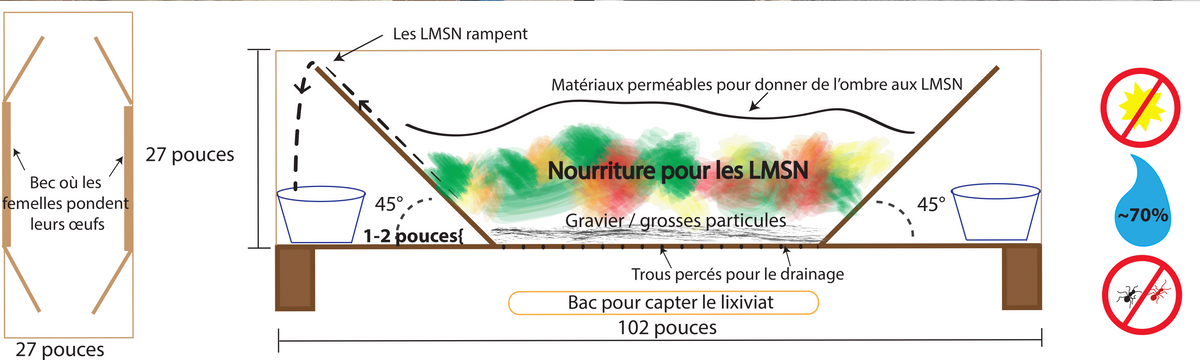
[Note de l’éditeur : ce guide s’appuie sur un résumé de Chalermliamthong et Trail (2021; http://edn.link/rqa3hk) du système de production de larves de mouches soldats noires au centre de ressources de la petite ferme de ECHO en Asie à Chiang Mai, en Thaïlande. Le système de production y sert d’approche pour intensifier la production de larves en tant que source de protéines alternative aux farines de poisson et de soja pour l’alimentation du bétail agricole. Les auteurs encouragent l’adaptation aux besoins, aux ressources et aux contraintes de votre contexte local. La fin de cet article comprend quelques considérations pour les opérations au niveau des ménages. Si vous avez des questions ou des expériences à partager, veuillez publier sur ECHO Conversations.]
Introduction et justification

Figure 1. Gros plan d’une mouche soldat noire adulte (Hermetia illucens). Source: Andre Fonseca
La mouche soldat noire (Hermetia illucens; Figure 1), ci-après abrégée en MSN, est originaire des Amériques mais s’est propagée dans le monde entier. Les mouches soldats noires (MSN) sont de la classe Insecta, de l’ordre des diptères (vraies mouches, ayant deux ailes) et de la famille des Stratiomyidae (mouches soldats). Les MSN adultes émettent un fort bourdonnement lorsqu’elles volent, provoquant une confusion avec les guêpes (qui ne sont pas de vraies mouches, ayant quatre ailes au lieu de deux et un dard).
Les larves de MSN (LMSN) sont produites pour leur biomasse riche en protéines et en matières grasses qui peut être donnée en nourriture à de nombreux types de bétail. Les LMSN séchées contiennent entre 37 % et 63 % de protéines (avec des acides aminés essentiels), entre 7 % et 28 % de matières grasses et sont une riche source de vitamines et de minéraux (Barragan-Fonesca et al., 2017 ; Zulkifli et al., 2022). Le profil nutritionnel des larves dépend de leur alimentation (matière première). Sur la base d’un examen des valeurs de protéines brutes et de matières grasses brutes par Barragan-Fonesca et al. (2017), vous pouvez obtenir des valeurs élevées de protéines (40 % ou plus) et de matières grasses (20 % ou plus) avec du fumier animal (par exemple, de bovins, de poulets, de porcs), des déchets de poisson et du tourteau de palmiste. Des larves contenant près de 40 % de protéines peuvent être obtenues avec des déchets de fruits et légumes, mais les valeurs en matières grasses seront inférieures à celles d’autres types de déchets organiques (<10 %).
Avec leurs appétits voraces, les LMSN se nourrissent de fruits en décomposition, de légumes, de carcasses d’animaux, de divers types de fumier animal, etc. Les LMSN sont de très grandes consommatrices, nécessitant 4,5 à 10 kg de déchets organiques pour produire 1 kg de biomasse larvaire (Rehman et al., 2022). En comparaison, il faut souvent 10 kg d’aliments pour produire 1 kg de viande de bœuf (Smil, 2002). La matière qui reste après la récolte des larves contient un mélange d’excréments (excréments de larves et exosquelettes) et de résidus de la matière organique donnée aux larves. Elle est souvent utilisée ou vendue comme amendement de sol.
La production de LMSN offre un moyen peu coûteux de convertir les déchets de la ferme en produits utiles. Transformer les déchets en ressources améliore la résilience des fermes, crée des opportunités génératrices de revenus et résout les problèmes environnementaux associés aux décharges et à l’accumulation de fumier. Les larves de la mouche domestique commune (Musca domestica) se nourrissent également de déchets organiques ; cependant, elles ne se nourrissent pas d’une gamme de matières aussi large que les LMSN. De plus, contrairement aux mouches domestiques, les adultes de la MSN ne sont pas un ravageur nuisible; ils ne mordent ni ne piquent et ne dérangent pas les humains. Les vers de compost utilisés pour le lombricompostage ont des utilisations différentes des larves de MSN. Pour plus d’informations sur le lombricompostage, voir la Note technique 66 de ECHO : Vermiculture Basics & Vermicompost ECHO Technical Note 66: Note Techniques de ECHO 66: Les Dejections des Vers.
Risque de maladie
Les matières organiques en décomposition peuvent être porteuses d’agents pathogènes qui peuvent affecter la santé animale et humaine. La partie médiane de l’intestin des LMSN est connue pour être très acide (pH ≤ 3 selon Bruno et al., 2019) et pour contenir des substances et des organismes fongiques ayant une activité contre des agents pathogènes tels que Staphylococcus aureus et Salmonella spp. (Gorrens et al., 2021 ; Zhang et al., 2022). Il existe cependant des preuves de la survie des agents pathogènes dans les intestins des MSNL (Müller et al., 2019).
Une grande partie de la littérature sur la MSN indique que les mouches adultes ne transmettent pas de maladies puisqu’elles ne piquent pas et qu’elles dépendent des graisses accumulées au stade larvaire pour se nourrir. Bruno et al. (2019), cependant, ont montré que les adultes ont en fait la capacité de manger et de digérer les aliments, ce qui augmente la possibilité de transmission de maladies.
Étant donné que les MSN sont associés à des déchets organiques en décomposition et que des structures reproductives de parasites animaux ont été trouvées dans les intestins de LMSN, la transmission de maladies est possible (Goddard, 2003 ; Müller et al., 2019). Nyangena et al. (2020) ont expérimenté les options suivantes pour réduire ou éliminer les agents pathogènes :
- Faire bouillir les larves pendant 5 minutes
- Cuisson à feu vif à 150°C pendant 5 min en retournant régulièrement les larves pour éviter que les larves ne se collent ou ne brûlent
- Séchage des larves au four à 60°C jusqu’à ce qu’il n’y ait plus de perte de poids, ce qui prend 2-3 jours
- Larves séchant au soleil dans une boîte recouverte de plastique transparent
Les traitements qui ont éliminé Salmonella dans les MSNL étaient l’ébullition, la grillade et des combinaisons d’ébullition ou de grillade suivies d’un séchage au soleil ou au four. Le séchage a l’avantage supplémentaire de concentrer les nutriments et de permettre le stockage des larves. Les traitements thermiques ont également réduit les agents pathogènes humains dans les LMSN dans une étude de Soomro et al. (2021), le séchage au four pendant 22 minutes à 150°C étant la méthode la plus efficace.
Le fait de procéder ou non à un traitement post-récolte des larves et les méthodes à adopter dépendent de facteurs tels que l’utilisation finale. Alors qu’un agriculteur peut donner des LMSN vivantes à du bétail tel que de la volaille et du poisson, une plus grande prudence est recommandée si les larves doivent être utilisées pour la consommation humaine. De nombreuses approches de traitement post-récolte nécessitent une source d’énergie, un facteur qui doit être pris en compte avec la quantité de larves à traiter. Voir le chapitre 5 de Black Soldier Fly Biowaste Processing de Dortmans et al. (2021) ou la vidéo de l’ICIPE sur le traitement des larves pour plus d’informations sur les méthodes de séchage, y compris un traitement thermique à petite échelle appelé grillade au sable.
Cycle et conditions de vie
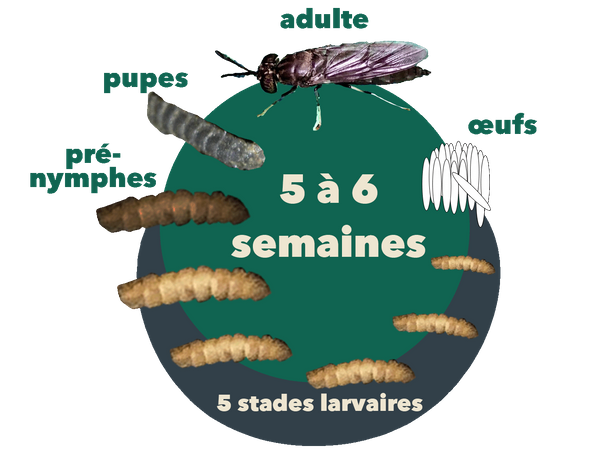
Figure 2. Le cycle de vie du MSN, qui dure environ 45 jours dans son intégralité. Source: Stacy Swartz
Comme le montre la figure 2, les MSN subissent cinq stades de développement : œuf, larve, pré-nymphe, nymphe et adulte (Rehman et al., 2022). Les mouches adultes déposent leurs œufs dans des crevasses sèches à proximité de matières organiques en décomposition. Les œufs éclosent après environ 4 jours, produisant des larves qui se nourrissent de déchets organiques sur une période de 13 à 18 jours en passant par cinq stades de développement appelés instars. Au fur et à mesure qu’elles grandissent, elles perdent leur exosquelette entre les stades instars. Après le cinquième stade, les larves s’assombrissent lorsqu’elles atteignent le stade prénymphal (sixième stade). Les pré-nymphes cessent de se nourrir et migrent loin de leur source de nourriture vers un endroit sec où elles entrent au stade nymphal. Deux semaines plus tard, des mouches adultes sortent de la peau de nymphes.
Les MSN préfèrent un climat chaud. Tomberlin et al. (2009) ont constaté que les taux de survie et de croissance des LMSN étaient les plus élevés à 27 °C et que la plage supérieure de développement des MSN se situe entre 30 et 36 °C. De même, Chia et al. (2018) ont constaté que la viabilité des œufs de MSN était la plus élevée (80 %) à 30 °C et la plus faible (< 11 %) à 15 et 40 °C. Entre les températures minimales et maximales auxquelles les LMSN se développeront, les larves se développent plus lentement et atteignent une taille plus grande à des températures plus fraîches (Tomberlin et al., 2009). À l’inverse, elles croissent plus vite et atteignent une taille plus petite à des températures plus chaudes.
En ce qui concerne l’humidité, bien que les LMSN tolèrent une plage d’humidité relative de 30 % à 90 % (Sheppard et al., 2002), 50 % à 70 % est optimal (Barry, 2004). Des conditions trop humides entraînent une réduction de l’oxygène dans la matière première. Des conditions trop sèches entraîneront la mortalité des larves en raison de la dessiccation.
Reproduction en captivité
Les larves de MSN sont produites à l’aide de systèmes dont la taille varie de petits bacs, seaux ou auges à des enceintes de la taille d’une pièce pour une production à plus grande échelle. Indépendamment de la taille ou de l’échelle, les principes de base et les étapes sont similaires. Le système décrit ci-dessous est celui d’un système utilisé par le personnel de ECHO en Asie qui produit environ 10 kg de larves par semaine. Une section ultérieure de cet article mettra en évidence les concepts utilisés dans les systèmes à petite échelle.
Étape 1. Obtenir une population de larves de départ
Pour démarrer un système de production de larves de MSN, achetez des larves auprès d’une source locale ou faites éclore des œufs de MSN à partir de mouches sauvages présentes dans votre région. Cette dernière option offre un moyen de commencer avec des MSN dans les zones où il n’y a pas de sources de larves à acheter. En commençant par les œufs, si la température de l’air est favorable (près de 30°C), vous pouvez rapidement obtenir suffisamment d’individus pour démarrer une colonie de MSN. Tomberlin et al. (2002) ont observé que le nombre d’œufs pondus par MSN femelle variait de 206 à 639.
Les procédures de base pour la collecte des œufs de MSN sauvage sont les suivantes :
A. Préparez un appât. Les options pour un appât comprennent les fruits pourris, les restes de cuisine, du son fermenté (couche externe de grains enlevée pendant le broyage) et du fumier. Lamine et al. (2022) ont découvert que l’ananas pourri fonctionnait mieux que les bananes pourries ou le son fermenté comme attractif. Ils ont attribué le succès de l’ananas pourri à sa forte odeur. L’utilisation de fruits pourris comme attractif consiste à les écraser pour obtenir une texture crémeuse, à ajouter de l’eau au besoin et à les placer dans un bol ou une bassine. Si vous utilisez du son, faites-le fermenter en le mélangeant dans un rapport 1: 1 avec de l’eau, en laissant reposer le mélange pendant 3 jours, puis en le combinant avec de la purée de bananes (voir la vidéo YouTube d’Adi en Indonésie intitulée Best Attractant: Fast and Easy Way to Get Seeds of Black Soldier Fly [Une manière facile et rapide d’obtenir des semences de la mouche soldat noire]).
B. Placez le récipient avec l’appât dans un endroit extérieur où les MSN sont susceptibles de se trouver.

Figure 3. Un récipient rempli de fruits pourris, avec des blocs de bois empilés sur le dessus, pour attirer les mouches soldats noires adultes afin de recueillir leus œufs. Source: Tim Motis
C. Au-dessus du récipient, prévoyez une surface pour que les MSN femelles pondent leurs œufs. Les surfaces avec des fissures et des crevasses fonctionnent bien. Une bonne façon de le faire est de placer plusieurs piles de blocs de bois sur le récipient. Créez chaque pile en coupant des morceaux de bois à une longueur qui dépasse le diamètre du récipient. Empilez plusieurs morceaux de bois, puis fixez la pile avec un élastique autour de chaque extrémité (Figure 3). Comme suggéré par le personnel de ECHO en Asie, vous pouvez placer des cure-dents entre les morceaux de bois pour créer un espace entre les couches de bois afin que les mouches femelles adultes puissent y pondre leurs œufs.
D. Surveillez les piles de bois pour voir s’il y aurait des œufs. Si vous ne voyez pas d’œufs, cela pourrait signifier que les populations sauvages autour de l’appât sont inexistantes ou faibles. Dans ce cas, essayez de placer l’appât là où il y a probablement plus de MSN sauvages. Cherchez un endroit avec beaucoup de déchets organiques, comme près des dépotoirs. Si vous êtes dans un endroit qui n’est pas ensoleillé et chaud toute l’année, gardez à l’esprit que les MSN peuvent ne pas être actifs pendant les mois d’hiver frais.
E. Faites éclore les œufs pour obtenir des larves. Lorsque vous démarrez une colonie de MSN à partir d’œufs de MSN sauvages, l’enclos d’accouplement, décrit à l’étape suivante, est un bon endroit pour faire éclore les œufs. Par la suite, vous pourrez produire des œufs dans l’enclos d’accouplement au lieu de devoir les collecter à l’extérieur à partir de MSN sauvages.
Étape 2. Établissez un enclos d’accouplement

Figure 4. L’enclos d’accouplement de MSN blindée comprend des gicleurs aériens pour le contrôle de l’humidité. Ici, les mouches adultes s’accouplent et les femelles pondent des œufs. Source: ECHO Asia
L’établissement d’un enclos d’accouplement est nécessaire pour la production d’œufs et de LMSN. Les enclos d’accouplement peuvent aller de grandes salles grillagées, comme celle illustrée à la figure 4 de la ferme de ECHO en Asie, à des systèmes plus petits utilisant des moustiquaires ou même des paniers en filet. Quelle que soit l’échelle ou la conception, l’enclos d’accouplement doit maintenir une humidité adéquate (environ 70 % d’humidité relative) et une température de 24 à 38°C 1 tout en gardant les MSN à l’intérieur et en empêchant les parasites d’y accéder.
Prenez des dispositions pour les mouches adultes, y compris une source d’eau et de la végétation ou d’autres surfaces sur lesquelles elles pourront se cacher et s’accoupler. Une source de sucre comme le miel prolongera la durée de vie des adultes (Barragan-Fonseca et al., 2017). Les nymphes ne mangent pas de nourriture, vous n’avez donc besoin que d’une petite quantité de nourriture à proximité pour inciter les mouches femelles adultes à pondre des œufs.
Étape 3. Recueillez les œufs

Figure 5. À l’intérieur de l’enclos d’élevage, prévoir des blocs de bois avec de petites crevasses pour que les MSN femelles pondent leurs œufs. Les blocs sont placés au-dessus d’une source de nourriture, mais pas directement en contact. Les femelles adultes pondent leurs œufs dans les fissures entre les blocs de bois. Source: ECHO Asia
Pour recueillir les œufs de la MSN femelle adulte, prévoir du matériel favorable à la ponte dans l’enclos d’accouplement. La ferme de ECHO Asie a découvert que les petits blocs de bois fonctionnent bien et offrent à la fois un environnement de ponte accueillant et une méthode de collecte des œufs facile pour les travailleurs. L’utilisation de petits morceaux de carton peut être logique (Wong, 2020), mais les blocs de bois sont pratiques pour recueillir les œufs et résultent en des quantités d’œufs plus élevées, comme l’a constaté le personnel de ECHO en Asie. À ce stade, il est important de noter que les MSN ne pondent pas leurs œufs directement sur (ou dans) une source de nourriture, mais à proximité. Les blocs doivent être près d’une source de nourriture, comme illustré à la figure 5.

Figure 6. Une fois que les femelles ont pondu, retirez les blocs de bois et démontez-les pour accéder facilement aux œufs. Les cure-dents sont utilisés pour séparer les blocs, offrant de petits espaces pour que les femelles pondent leurs œufs. Source: ECHO Asia
Pour recueillir les œufs (Figure 6), retirez les blocs, séparez-les les uns des autres et grattez soigneusement les œufs avec un cure-dent ou tout autre petit objet pointu. Les œufs peuvent être d’âges différents si les travailleurs n’enlèvent pas les blocs chaque jour. En ayant des œufs d’âges différents, les larves éclosent et se développent à différents stades, nécessitant un tri et une séparation supplémentaires avant la maturité. Il est utile d’avoir des larves d’âge et de maturité uniformes lors de la production de lots plus importants de LMSN.
Étape 4. Passage des œufs aux larves

Figure 7. Placez doucement les œufs collectés sur une source de nourriture, en utilisant un grillage pour éviter le contact direct des œufs avec la nourriture humide. Une fois les œufs éclos, les larves migrent vers la source de nourriture. Source: ECHO Asia
ransférez les œufs recueillis vers une source de nourriture appropriée (voir l’étape 5) où ils écloront et ramperont jusqu’à la matière première fournie. Cela pourrait être dans une zone séparée. Utilisez un tamis à mailles pour séparer les œufs du contact direct avec la source de nourriture. Les œufs éclosent dans les quatre jours suivant la ponte. À ce stade, alors que les larves sont petites, vous pouvez utiliser des plateaux en plastique pour contenir de petites quantités d’aliments/déchets et de larves. Les LMSN s’alimenteront à une profondeur maximale d’environ 20 cm, donc la profondeur idéale du bac est d’au moins 20 cm mais pas plus de 60 cm (Barrios, 2019).
Étape 5. Choisissez une matière première appropriée
L’un des avantages des LMSN est leur capacité à consommer de nombreux types de déchets : les déchets municipaux à forte teneur en matière organique, les déchets de marché (fruits et légumes), les fumiers humains et animaux, les restes de table, la farine d’os et la plupart des autres produits (Figure 8). Cet article ne donnera pas une liste prescriptive des sources d’alimentation mais encourage le producteur à trouver les ressources dites « déchets » disponibles localement. Utilisez des sous-produits de déchets à faible coût, voire gratuits, notamment les déchets du marché, les restes de nourriture des cafétérias, le son de riz, les drêches, les tourteaux de soja, etc. Les LMSN préfèrent les aliments riches en graisses, en protéines et en amidons. Le tableau 1 indique les facteurs à prendre en compte lors du choix des matières premières.

Figure 8. Les options de sources alimentaires pour la production de LMSN comprennent la sélection de déchets tels que les déchets d’ananas et les sous-produits collectés sur le marché. Source: ECHO Asia

Figure 9. Pour vous assurer que les LMSN se deviennent fortes et en bonne santé, mélangez des sous-produits de déchets de qualité supérieure tels que le son de riz et la farine de soja, avec des sous-produits de déchets de qualité inférieure. Source: ECHO Asia
Comme indiqué dans le tableau 1, vous pouvez mélanger les déchets pour garantir une source d’alimentation équilibrée ou « complète » (figure 9). Cela aide à « renforcer» la matière première pour assurer des rendements plus élevés en larves produites. Par exemple, vous pouvez augmenter la teneur en protéines des déchets végétaux en ajoutant du fumier de poulet. Vous ne devez pas y ajouter des animaux malades ou leurs abats, des copeaux de bois, des articles contaminés par des pesticides ou trop de matières végétales très fibreuses (Barrios, 2019). Faites des expérimentations avec différentes matières premières pour découvrir ce qui vous convient le mieux.
| Type de déchets organiques | Avantages et/ou inconvénients | Source de la littérature |
|---|---|---|
| Déchets de fruits et légumes | Moins d’odeur que la viande pourrie. Peut être faible en protéines et en matières grasses, ce qui peut retarder le temps de maturation et le poids des larves | Nguyen et al. (2013) |
| Déchets de poisson | Riche en matières grasses, mais le poisson peut également accumuler des métaux lourds toxiques pour les LMSN | Nguyen et al. (2013) |
| Restes de cuisine | Bien équilibré, contenant à la fois des déchets végétaux et de viande | Nguyen et al. (2013) |
| Déchets fibreux comme les coques d’amandes, la paille de riz | Augmente l’oxygène pour les larves mais le rapport carbone/azote élevé réduit le poids des larves ; peut ajouter des déchets végétaux riches en azote pour réduire le rapport carbone/azote | Palma et al. (2019) |
| Alimentation à haute teneur en humidité | Trop d’humidité peut entraîner des conditions anaérobies et réduire la croissance des larves ; peut atténuer avec la ventilation et l’incorporation de matériaux à haute teneur en fibres | Yakti et al. (2023) |
| Fumier de bétail et de volaille | Teneur en protéines plus élevée avec le fumier des omnivores (par exemple, les poulets, qui mangent des aliments végétaux et animaux) que les herbivores (par exemple, les bovins, qui se nourrissent d’herbes) | Xiao et al. (2020); Chen et al. (2003) |
Étape 6. Augmenter la production

Figure 10. Un système de LMSN à grande échelle au nord de la Thaïlande utilisant des baies individuelles avec différentes sources de déchets pour élever des LMSN à différents stades de leur cycle de vie. Source: ECHO Asia
Au fur et à mesure que les larves éclosent et se nourrissent, elles doivent être « mises à l’échelle » dans des récipients ou des bassins plus grands pour une production adéquate. Au cours de cette étape, fournissez plus de matière première pour que les larves puissent se nourrir. La quantité de nourriture à ajouter dépendra du stade larvaire, de la température, de la matière première et d’autres facteurs. Vérifiez les larves au moins une fois par jour pour vous assurer qu’il y a toujours un approvisionnement alimentaire suffisant pour les larves en croissance. Lorsque vous ajoutez de nouveaux aliments, assurez-vous de mélanger uniformément les anciens et les nouveaux aliments dans tout le bassin/récipient ou ajoutez les anciennes matières premières et larves au-dessus d’un bac avec de nouvelles matières premières. Les larves sont photophobes (craignant la lumière) et descendront vers la nouvelle matière première.
***REMARQUE : Il est essentiel de contrôler l’humidité pour éviter des odeurs nauséabondes provenant de la pourriture des matières premières. Les tas d’aliments ou de déchets ne doivent jamais être anaérobies (manquant d’oxygène). Les plateaux ou les bassins doivent avoir un moyen d’évacuer l’excès d’humidité pour éviter tout liquide stagnant. 2 Un bon drainage aidera également à empêcher la matière première d’attirer les mouches nuisibles telles que la mouche domestique; combiner un bon drainage avec une couverture adéquate (couvercles ou crible) pour empêcher les mouches domestiques de pondre des œufs dans la source de nourriture et d’infecter la colonie de MSN. La Ferme de ECHO en Asie utilise une matière sèche, telle que du son de riz ou de la poudre de riz, pour absorber l’humidité selon les besoins.
Étape 7. Récoltez les larves

Figure 11. Tri et calibrage des LMSN. Source: ECHO Asia
Sur une période de 13 à 18 jours, les larves se nourrissent avec voracité, mangeant deux fois l’équivalent de leur propre poids corporel chaque jour (Shishkov et al., 2019). Il existe plusieurs façons de récolter les larves.
La récolte des larves avant qu’elles n’atteignent la maturité (peu avant le stade de pré-nymphe) nécessite le tri, le calibrage ou la séparation des larves de leur matière première. Pour les larves qui sont données directement en nourriture au bétail, il n’est pas nécessaire de les retirer de la source d’alimentation. Le tri et le calibrage sont courants pour les grands systèmes de production, mais ces activités demandent une forte main-d’œuvre. Pour faciliter la séparation, nous recommandons les options suivantes:
- À la fin de leur cycle de production, transférer les larves vers une source d’alimentation à texture plus fine (par exemple, le son). Des particules de nourriture uniformément petites seront alors faciles à séparer des larves.
- Utilisez différentes tailles de crible pour faciliter le tri et le calibrage.

Figure 12. Un exemple de larves récoltées et triées. Source: ECHO Asia
Deux approches pour trier les larves en vue d’avoir une taille uniforme sont la récolte dans des conditions humides et sèches. La récolte dans des conditions humides consiste à utiliser de l’eau pour transporter les larves à travers des cribles plus larges et pousser les débris alimentaires plus petits à travers des cribles plus fins pour isoler les larves en vue de les donner en nourriture. La récolte dans des conditions sèches est accomplie en déplaçant ou en secouant les cribles à contenu mixte jusqu’à ce que les larves soient isolées des grandes et petites particules alimentaires (Figure 11). Les travailleurs peuvent trier à la main ou utiliser des secoueurs mécanisés, comme les technologies utilisées dans les systèmes de lombriculture. Une fois les larves récoltées et triées (Figure 12), elles peuvent être transformées pour une utilisation ultérieure comme aliment.
Étape 8. Élever des nymphes pour la reproduction

Figure 13. Un bassin d’auto-récolte de LMSN où les larves qui ont atteint le cycle pupal s’éloigneront de leur source de nourriture et tomberont dans des auges inférieures pour être collectées. Source: ECHO Asia
Le système « d’auto-récolte » de la ferme de ECHO en Asie (Figure 13) fonctionne très bien pour réapprovisionner l’enclos d’accouplement. Au stade de la vie pré-nymphale, les MSN migrent de leur source de nourriture à la recherche d’un endroit sombre et calme pour se transformer en des mouches matures. S’il est vérifié régulièrement, il peut être pratique et fournir un approvisionnement régulier en nymphes pour la reproduction. Transportez ces nymphes dans l’enclos d’accouplement avant que les mouches n’émergent.
Systèmes plus petits

Figure 14. Système de godets pour la production à petite échelle de LMSN. Bac en plastique utilisé pour attraper les pré-nymphes auto-récoltées. Source: JC Barrios
Il existe de nombreux exemples en ligne de petits systèmes domestiques pour l’élevage de mouches soldats noires. Ceux-ci utilisent des bacs, des seaux (Figure 14) et des auges (Figure 15). Avec tous les systèmes plus petits, assurez-vous d’avoir une couverture sur le système pour protéger les LMSN des pluies et des prédateurs.

Figure 15. Abreuvoir construit pour la production de LMSN à l’intérieur du poulailler. Source: JC Barrios
Lorsque vous utilisez un seau ou un bac, laissez des trous dans le couvercle suffisamment grands pour permettre aux MSN femelles sauvages d’entrer dans le seau et de pondre des œufs. Si vous êtes dans un climat pluvieux, vous pouvez attacher du PVC en forme de «T» sortant du bac pour permettre aux femelles d’entrer dans le dispositif sans mouiller la matière première. Des morceaux de carton peuvent être empilés en couches et attachés au sommet des auges, des seaux ou des bacs pour fournir un endroit où les MSN femelles sauvages peuvent pondre des œufs. Si vous utilisez des bacs ou des seaux avec des couvercles, les femelles peuvent pondre entre le couvercle et les bords du bac. Grattez ces œufs dans la matière première tous les trois à quatre jours. L’un des avantages de l’utilisation de seaux ou de bacs empilés est que vous pouvez percer des trous dans le seau ou le bac intérieur et récupérer le lixiviat pour une utilisation ultérieure dans un seau ou un bac extérieur. Alternativement, vous pouvez placer un système de captage sous les trous de drainage pour collecter le lixiviat (Figure 16).
Figure 16. Schéma d’un système d’abreuvoirs qui comprend des systèmes de captage de lixiviats et de prénymphes. Source: Stacy Swartz
De nombreux petits systèmes de MSN utilisent la nature «d’auto-récolte» des LMSN pour la récolte. Comme on le voit dans l’exemple (Figure 16), les installations évacuent les nymphes rampantes de la source de nourriture. Vous pouvez placer votre dispositif à l’intérieur de votre enclos pour bétail pour permettre au bétail de se nourrir immédiatement des pré-nymphes tombées (Figure 15) ou vous pouvez placer un récipient avec des côtés non texturés (par exemple, en plastique) sous le bord de la rampe pour attraper les larves. Avec cette pratique, une certaine évasion est inévitable, mais les individus échappés aident à soutenir la population sauvage de MSN.
Avec des systèmes plus petits, vous devrez peut-être investir dans une défense supplémentaire contre les prédateurs pour empêcher la vermine et autres charognards d’entrer dans les bacs/auges. Le personnel de ECHO en Floride a utilisé des planches de bois plombées de blocs de ciment pour exclure les ratons laveurs et les rats.
Défis de production à prendre en compte
Ravageurs
Les concepteurs doivent tenir compte des ravageurs tels que les oiseaux, les rats et d’autres ravageurs possibles avant d’établir un dispositif de MSN à n’importe quelle échelle. Des dispositifs fermés sont nécessaires pour garder les MSN à l’intérieur et les parasites indésirables à l’extérieur. Malheureusement, le processus nécessaire d’installation des cribles et des filets peut devenir coûteux et augmenter considérablement la rentabilité d’un producteur.
Odeurs nauséabondes
Le succès de tout dispositif de MSN dépend du contrôle de l’humidité. De nombreux déchets alimentaires, tels que les restes de fruits, ont une teneur élevée en humidité et peuvent rendre les dispositifs anaérobies. La prévention des conditions anaérobies est essentielle au succès global du système et à la perception des voisins et des clients. Installez des options de drainage ou utilisez des sons ou des farines pour absorber l’excès d’humidité. Si vous voyez des agrégats de nourriture, brisez-les pour aider les larves à consommer la source de nourriture.
Migration prématurée des larves
S’il n’y a pas assez de matière première, les larves tenteront de quitter le dispositif, rampant hors des enclos à la recherche de nourriture. Pour atténuer cette migration, vérifiez fréquemment les larves pour assurer un approvisionnement alimentaire adéquat.
Utilisation de la mouche soldat noire dans les aliments pour bétail
La volaille
Les LMSN s’avèrent être un complément nutritif aux aliments pour animaux. La farine à base de LMSN sert d’alternative à la farine de soja et à la farine de poisson comme source de protéines dans l’alimentation des volailles (Fanatico et al., 2018). Cela a été démontré pour les poulets élevés pour la production d’œufs (poules pondeuses) et de viande (poulets de chair). Voici quelques-uns des rapports que nous avons trouvés dans la littérature pour les pondeuses et les poulets de chair :
- Pondeuses : il a été démontré que le remplacement par de la farine de MSN de jusqu’à 100 % de la farine de poisson utilisée dans l’alimentation des volailles augmente le poids corporel et la production d’œufs des poules pondeuses (Attivi et al., 2022 ; Zhao et al., 2022). Étudiant des poules élevées en liberté, Ruhnke et al. (2018) ont constaté que les poulets auxquels on donnait des LMSN séchées consommaient environ 15 g de LMSN par jour, soit 16 % de leur alimentation. Ils ont suggéré que, compte tenu des formulations alimentaires, les LMSN pourraient être un complément protéique viable à long terme, notant que le séchage des LMSN à des températures élevées (90 ° C) peut réduire la disponibilité de certains acides aminés (lysine, arginine et thréonine).
- Poulets de chair: la farine de LMSN a été donnée à la volaille avec des effets bénéfiques à divers stades de développement du poulet de chair (de Souza Vilela et al., 2021). Cheng et al. (2023) ont constaté que les poussins de chair prenaient un poids statistiquement similaire avec des LMSN séchées qu’avec la farine de poisson et la farine de soja. Moula et al. (2018) ont montré que le gain de poids hebdomadaire de la volaille locale s’améliorait lorsque 8 % d’un aliment commercial standard était complété par des LMSN fraiches et entières qui étaient décongelées après avoir été congelées.
L’incorporation de LMSN dans les aliments pour volailles offre aux poulets une alimentation plus diversifiée, ce qui est bon pour la santé globale des oiseaux. L’étude de Moula et al. (2018) ont montré que les avantages des LMSN (par exemple, le gain de poids) pouvaient être obtenus avec des larves élevées sur de petits systèmes qui fonctionnent bien dans le contexte de la petite agriculture.
Aquaculture
La baisse des captures de poissons sauvages fait à la fois augmenter les prix et stimule l’aquaculture pour produire plus de poissons. La farine de poisson et les protéines végétales produites agronomiquement telles que le soja ne peuvent pas soutenir de manière adéquate les augmentations de l’aquaculture. Les LMSN se sont révélées prometteuses en tant que substitut viable de la farine de soja et de la farine de poisson. Le remplacement de 30 % de la farine de céréales (de soja, de maïs et de blé) par des excréments de MSN a augmenté le poids du tilapia et sa résistance aux maladies par rapport à la farine de céréales seule (Yildirim-Askoy et al., 2020).
Zarantoniello et al. (2020) ont souligné que la farine de LMSN est souvent riche en graisses saturées (malsaines) et déficiente en graisses polyinsaturées (saines). Pour booster les graisses polyinsaturées des larves nourries avec du marc de café, Zarantoniello et al. (2020) ont ajouté des microalgues d’eau douce (Schizochytrium sp.) à la matière première. Ils ont découvert que les larves nourries avec une combinaison de marc de café et de microalgues augmentaient les graisses polyinsaturées dans les LMSN et que la farine de LMSN résultante pouvait remplacer jusqu’à 50 % de la farine de poisson dans les aliments pour poissons.
Les LMSN peuvent également être utilisées en aquaponie, une forme d’aquaculture dans laquelle la pisciculture est liée à la production végétale. Les plantes des systèmes aquaponiques utilisent les éléments nutritifs des déchets de poisson. Romano et al. (2022) ont découvert que les excréments de MSNL, transformés en une dilution ou un thé (à un taux de 0,09 g par 40 ml, avec la solution de 40 ml résultante ajoutée à chaque réservoir de 1000 L utilisé dans l’essai), augmentaient les niveaux de calcium, de potassium, et de phosphore dans l’eau. Ils ont mentionné que le calcium, le potassium et le fer limitent souvent la croissance des plantes dans les systèmes aquaponiques.
Les cochons
Il a été constaté que les porcs préfèrent des LMSN vivantes à d’autres aliments comme le maïs et les granulés alimentaires commerciaux (Ipema et al., 2021). Les porcs mangeront également des LMSN qui ont été séchées et broyées en poudre pour faire de la farine de LMSN. La farine de LMSN est une bonne source de protéines pour les porcs et améliore leur santé intestinale (Kar et al., 2021). Les LMSN peuvent remplacer au moins une partie d’autres sources de protéines comme le soja et la farine de poisson, sans aucun effet négatif sur la croissance ou la qualité de la viande de porc (Hong et Kim, 2022).
L’élevage de LMSN fournit également aux agriculteurs un moyen d’éliminer le lisier de porc. Parodi et al. (2021) ont découvert que les LMSN incorporaient dans leur corps 12 % du carbone et 25 % de l’azote contenus dans le lisier frais sur lequel elles ont été élevées. Le stockage des éléments nutritifs dans les LMSN les empêche d’être perdus par lessivage, atténuant ainsi la pollution des eaux souterraines associée à l’accumulation de lisier frais.
Les ruminants
Les farines d’insectes peuvent être utilisées pour pallier les pénuries de farine de poisson et de suppléments protéiques à base de plantes pour les ruminants (Castillo et Hernández, 2023). Jayanegara et al. (2017) ont montré que la teneur élevée en chitine dans les LMSN diminue la digestibilité, suggérant que cela soit pris en compte lors de l’élaboration de formulations d’aliments pour le bétail. D’autre part, leurs travaux ont montré qu’une teneur élevée en chitine est liée à une réduction des émissions de méthane (un gaz à effet de serre) dans le rumen. Les LMSN peuvent être utilisées pour compléter le régime alimentaire des jeunes animaux qui allaitent encore et comme source de probiotiques (Astuti et al., 2022).3
Utilisation de sous-produits comme engrais
Les excréments d’insectes ou de larves d’insectes sont un sous-produit de l’élevage d’insectes et peuvent être utilisés dans les champs ou en pépinière. Les excréments de MSN peuvent être trempés dans l’eau pour faire un « thé de compost» qui peut être appliqué comme arrosage du pied. Les excréments peuvent également être ajoutés au terreau ou placés au fond des sillons avant de semer les cultures directement dans le sol. Les valeurs nutritives de la MSN varient en fonction de la matière première. Les chercheurs Lopes et al. (2022) ont examiné diverses études et ont découvert que les déjections de légumes enrichis de LMSN contenaient des valeurs N-P-K (azote-phosphore-potassium) de 2,8-1,5-3,3, par rapport aux fumiers de vaches 1,9-1,0-0,2, de volaille 2,3-1,1-1,8, et de porcs 2,4-2,1-1,0 nourris de larves. Comme d’autres alternatives d’engrais ou d’amendements de sol, il s’agit d’une pratique volumineuse nécessitant 3 571 kg de matière pour 100 kg de N. L’incorporation de déjections de MSN comme amendement de sol présente des avantages supplémentaires tels que l’amélioration de la structure du sol, l’augmentation de la matière organique du sol et les capacités de rétention d’eau.
Si vous facilitez le drainage dans votre système, le lixiviat collecté peut également être utilisé comme engrais. Le lixiviat collecté peut être dilué et utilisé comme engrais. Green (2013) a observé une amélioration de la croissance des plantes avec du lixiviat de MSN dilué dans de l’eau (par exemple, 1 partie de lixiviat de MSN mélangé à 9 parties d’eau) et appliqué par arrosage du pied ou par pulvérisation foliaire.
Dernières réflexions
La production de LMSN offre aux agriculteurs un moyen d’obtenir des protéines pour l’alimentation animale, de traiter et de recycler les déchets à la ferme et de générer des sous-produits tels que les déjections et les lixiviats pour l’amélioration des sols. Les systèmes varient en échelle, des petits bacs et récipients aux systèmes à plus grande échelle avec des enclos d’accouplement dédiés. Des approches à petite et à grande échelle peuvent être mises en œuvre avec des matériaux d’usage courant.
Bien que les étapes de l’élevage de LMSN ne soient pas difficiles à mettre en œuvre, il est important de comprendre les facteurs qui influencent la croissance et la qualité des LMSN. Certains facteurs qui ont été identifiés dans ce document comprennent la température/l’humidité, la matière première, les caractéristiques de la matière première telles que la teneur en humidité et la profondeur, et les options de traitement. Un agriculteur devra également tenir compte de facteurs économiques tels que la disponibilité des matières premières, la quantité de larves nécessaires, la faisabilité de la transformation et le coût des matériaux.
Ressources additionnelles
ECHO Asia virtual training on BSF Production [Formation virtuelle de ECHO en Asie sur la production de MSN]
Informations du Critter Depot sur:
Les déjections de MSN: https://www.thecritterdepot.com/blogs/news/nutritional-benefits-of-black-soldier-fly-larva-frass-critter-depot
Étapes de la vie des mouches soldats noires: https://www.thecritterdepot.com/blogs/news/nutritional-benefits-of-black-soldier-fly-larva-frass-critter-depot#:~:text=The%20frass%20sold%20by%20The,types%20of%20manure%20and%20compost
Composition nutritionnelle : https://kimmyfarm.com/en/nutritional-value-of-black-soldier-fly-larvae#sun-dried-bsf-black-soldier-fly-larvae-fresh-high-quality
Conseils pour nourrir les poulets: https://www.backyardchickens.com/articles/feeding-chickens-an-introductory-guide.67139/
Farine d’insectes comme aliment pour animaux: https://www.feedipedia.org/content/insect-meals-animal-feed
Série de vidéos Black Soldier Fly du Centre international de physiologie et d’écologie des insectes (ICIPE) (6 épisodes) : https://www.youtube.com/watch?v=-8vejnFgndk
Citer comme suit:
Chalermliamthong S., P. Trail, R. Walle, et T. Motis. 2023. Production de larves de mouches soldats noire. Note technique de ECHO n°99.
Références
Astuti, D.A. et K.G. Wiryawan. 2022. Black soldier fly as feed ingredient for ruminants [La mouche soldat noire comme ingrédient alimentaire pour les ruminants]. Animal Bioscience 35(2):356-363.
Attivi, K., K.G. Mlaga, K. Agboka, K. Tona, Y.A.E. Kouame, H. Lin, et K. Tona. 2022. Effect of fish meal replacement by black Soldier Fly (Hermetia illucens) larvae meal on serum biochemical indices, thyroid hormone and zootechnical performance of laying chickens [Effet du remplacement de la farine de poisson par la farine de larves de mouche soldat noire (Hermetia illucens) sur les indices biochimiques sériques, les hormones thyroïdiennes et les performances zootechniques des poules pondeuses]. Journal of Applied Poultry Research, Vol. 31(3) 100275.
Barragan-Fonseca, K.B., M. Dicke, et J.J.A. van Loon. 2017. Nutritional value of the black soldier fly (Hermetia illucens L.) and its suitability as animal feed – a review [Valeur nutritionnelle de la mouche soldat noire (Hermetia illucens L.) et son aptitude à l’alimentation animale – Revue]. Journal of Insects as Food and Feed. 3(2):105-120. https://avingstan.com/wordpress/wp-content/uploads/2019/08/Barragan-Fonseca-et-al-2017-Nutritional-value.pdf. Consulté le 13 janvier 2023.
Barrios, J.C. 2019. Black soldier fly larvae: Biology and life cycle, basic husbandry, and feeding logistics [Larves de mouches soldats noires : biologie et cycle de vie, élevage de base et logistique d’alimentation]. Exposé présenté lors de la Conférence internationale sur l’agriculture ECHO 2019.
Barry, T. (Ph.D. dissertation). 2004. Evaluation of the Economic, Social, and Biological Feasibility of Bioconverting Food Wastes With the Black Soldier Fly (Hermetia illucens) [Évaluation de la faisabilité économique, sociale et biologique de la bioconversion des déchets alimentaires avec la mouche soldat noire (Hermetia illucens)]. University of Texas, 176 pp.
Bruno, D. M. Bonelli, F. De Filippis, I. Di Lelio, G. Tettamanti, M. Casartelli, D. Ercolini, et S. Caccia. 2019. The intestinal microbiota of Hermetica illucens larvae is affected by diet and shows a diverse composition in the different midgut regions [Le microbiote intestinal des larves d’Hermetica illucens est affecté par le régime alimentaire et présente une composition diversifiée dans les différentes régions de l’intestin moyen]. Applied and Environmental Microbiology 85(2): e01864-18.
Castillo, C., et J. Hernández. 2023. Insects in ruminant nutrition as an urgent measure in the light of the scarcity of raw feedstock [Les insectes dans l’alimentation des ruminants comme mesure urgente face à la rareté des matières premières]. Research in Veterinary Science, Vol.155:124-125.
Chalermliamthong, S. et P. Trail. 2021. Establishing a scaled-up black soldier fly system [Mise en place d’un système de mouches soldats noires à grande échelle]. ECHO Asia Note 47:1-7.
Chen, S., W. Liao, C. Liu, Z. Wen, R.I. Kincaid, J.H. Harrison, D.C. Elliott, M.D. Brown, A.E. Solana, et D.J. Stevens. 2003. Value-added chemicals from animal manure [Produits chimiques à valeur ajoutée issus du fumier animal]. Laboratoire des sciences moléculaires de l’environnement, Laboratoire du nord-ouest du Pacifique. https://doi.org/10.2172/15009485.
Cheng, V., A.K. Shoveller, L.A. Huber, et E.G. Kiarie. 2023. Comparative protein quality in black soldier fly larvae meal vs. soybean meal and fish meal using classical protein efficiency ratio (PER) chick growth assay model [Comparaison de la qualité des protéines dans la farine de larves de mouche soldat noire par rapport à la farine de soja et à la farine de poisson à l’aide d’un modèle classique d’essai de croissance de poussins à coefficient d’efficacité protéique (CEP)]. Poultry Science, Vol. 102 (1)102255.
Chia, S.Y., C.M. Tanga, F.M. Khamis, S.A. Mohamed, D. Salifu, S. Sevgan, K.K. M. Fiaboe, S. Niassy, J.J.A. van Loon, M. Dicke, et S. Ekesi. 2018. Threshold temperatures and thermal requirements of black soldier fly Hermetia illucens: Implications for mass production [Températures seuils et exigences thermiques de la mouche soldat noire Hermetia illucens: implications pour la production de masse]. PLOS ONE 13(11): e0206097.
de Souza Vilela, J., N.M. Andronicos, M. Kolakshyapati, M. Hilliar, T.Z. Sibanda, N.R. Andrew, R.A. Swick, S. Wilkinson, et I. Ruhnke. 2021. Black soldier fly larvae in broiler diets improve broiler performance and modulate the immune system [Les larves de mouches soldats noires dans les régimes de poulets de chair améliorent les performances des poulets de chair et modulent le système immunitaire]. Animal Nutrition. 7(3):695-706.
Dortmans B.M.A., J. Egger, S. Diener, et C. Zurbrügg. 2021. Black Soldier Fly Biowaste Processing - A Step-by-Step Guide Guide [Traitement des déchets biologiques de la mouche soldat – Un guide étape par étape], 2e Edition Eawag: [Institut fédéral suisse des sciences et technologies aquatiques]
Fanatico, A.C., K. Arsi, I. Upadhyaya, J. Morales Ramos, D. Donoghue, et A.M. Donoghue. 2018. Sustainable Fish and Invertebrate Meals for Methionine and Protein Feeds in Organic Poultry Production [Farines de poissons et d’invertébrés durables pour la méthionine et les aliments protéinés dans la production de volaille biologique]. Journal of Applied Poultry Research. Vol. 27(4)437-448.
Fawole, F.J., S.N. Labh, M.S. Hossain, K. Overturf, B.C. Small, T.L. Welker, R.W. Hardy, et V. Kumar. 2021. Insect (black soldier fly larvae) oil as a potential substitute for fish or soy frass derived from black soldier fly larvae treatment of biodegradable wastes. a critical review and future perspectives [Huile d’insectes (larves de mouches soldats noires) comme substitut potentiel des excréments de poisson ou de soja dérivés du traitement de déchets biodégradables par des larves de mouche soldat noire]. Revue critique et perspectives d’avenir. Animal Nutrition Vol. 7 (4):1360-1370.
Goddard, J. 2003. Physician’s Guide to Arthropods of Medical Importance[Guide du médecin sur les arthropodes d’importance médicale], 4e Edition. CRC Press LLC. Boca Raton, Florida.
Gorrens, E. N. Van Looveren, L. Van Moll, D. Vandeweyer, D. Lachi, J. De Smet, et L. Van Campenhout. 2021. Staphyloccoccus aureus in substrates for black soldier fly larvae (Hermetia illucens) and its dynamics during rearing [Staphyloccoccus aureus dans les substrats pour les larves de la mouche soldat noire (Hermetia illucens) et sa dynamique au cours de l’élevage]. Food Microbiology 9(3): e02183-21.
Green, T. 2013. BSF & food scrap: putting the leachate to good use. DipTerra LLC- Specializing in Recycling with Black Soldier Fly Technologies [Spécialisée dans le recyclage avec les technologies de la mouche soldat noire]. https://www.dipterra.com/blog/bsf-food-scrap-putting-the-leachate-to-good-use
Hong, J. et Y.Y. Kim. 2022. Insect as feed ingredients for pigs [L’insecte comme ingrédient alimentaire pour les porcs]. Animal Bioscience 35(2):347-355.
Ipema, A.F., Gerrits, W.J.J, Bokkers, E.A.M. Kemp, B. et J.E. Bolhuis. 2021. Live black soldier fly larvae (Hermetia illucens) provisioning is a promising environmental enrichment for pigs as indicated by feed- and enrichment-preference tests [L’approvisionnement en larves vivantes de mouches soldats noires (Hermetia illucens) est un enrichissement environnemental prometteur pour les porcs, comme l’indiquent les tests de préférence d’alimentation et d’enrichissement]. Applied Animal Behaviour Science. Vol. 244:105481.
Jayanegara, A., B. Novandri, N. Yantina, et M. Ridla. 2017. Use of black soldier fly larvae (Hermetia illucens) to substitute soybean meal in ruminant diet: an in vitro rumen fermentation study [Utilisation de larves de mouche soldat noire (Hermetia illucens) pour remplacer le tourteau de soja dans l’alimentation des ruminants : une étude in vitro sur la fermentation ruminale]. Vet World 10(12):1439-1446.
Kar, S. K., D. Schokker, A.C. Harms, L. Kruijt, M.A. Smits, et A.J.M. Jansman. 2021. Local intestinal microbiota response and systemic effects of feeding black soldier fly larvae to replace soybean meal in growing pigs [Réponse locale du microbiote intestinal et effets systémiques du fait de donner des larves de mouche soldat noire en nourriture pour remplacer le tourteau de soja chez les porcs en croissance]. Scientific Reports 11:15088 https://doi.org/10.1038/s41598-021-94604-8
Lamin, S. A. Abrar, Arwinsyah, M. Kamal, et A.N. Sipahutar. 2022. The effect of some attractive medio on the number of marriage partners, eggs weight and lifetime of black soldier fly (Hermetia illucens L.) Biovalentia [L’effet de certains milieux attrayants sur le nombre de partenaires de mariage, le poids des œufs et la durée de vie de la mouche soldat noire (Hermetia illucens L.) Biovalentia]. Biological Research Journal 8(2):151-155.
Li, S., H. Ji, B. Zhang, J. Tian, J. Zhou, et H. Yu. 2016. Influence of black soldier fly (Hermetia illucens) larvae oil on growth performance, body composition, tissue fatty acid composition and lipid deposition in juvenile Jian carp (Cyprinus carpio var. Jian) [Influence de l’huile de larves de mouche soldat noire (Hermetia illucens) sur les performances de croissance, la composition corporelle, la composition en acides gras des tissus et le dépôt de lipides chez la carpe Jian juvénile (Cyprinus carpio var. Jian)]. Aquaculture Vol. 465:43-52.
Lopes, G., J. W.H. Yong et C. Lalander. 2022. Frass derived from black soldier fly larvae treatment of biodegradable wastes: a critical review and future perspectives [Déjections issues du traitement par les larves de mouches soldats noires des déchets biodégradables : bilan critique et perspectives d’avenir]. Waste Management 42:65-76.
Moula, N., M. Scippo, C. Douny, G. Degand, E. Dawans, J. Cabaraux, J. Hornick, R.C. Medigo, P. Leroy, F. Francis, et J. Detilleux. 2018. Performances of local poultry breed fed black soldier fly larvae reared on horse manure [Performances de volailles de race locale nourries de larves de mouches soldats noires élevées sur du fumier de cheval]. Animal Nutrition. 4(1)73-78.
Müller, A., S. Wiedmer, et K. Michael. 2019. Risk evaluation of passive transmission of animal parasites by feeding of black soldier fly (Hermetia illucens) larvae and prepupae [Évaluation du risque de transmission passive des parasites animaux par l’alimentation en larves et en prénymphes de mouches soldats noires (Hermetia illucens)]. Journal of Food Protection 82(6):948-954.
Nguyen, T.T.X., J.K. Tomberlin, et S. Vanlaerhoven. 2013. Influence of resources on Hermetia illucens (Diptera: Stratiomyidae) larval development [Influence des ressources sur le développement larvaire de Hermetia illucens (Diptera : Stratiomyidae)]. Journal of Medical Entomology 50(4):898-906.
Nyangena, D.N. C. Mutungi, S. Imathiu, J. Kinyuru, H. Affognon, S. Ekesi, D. Nakimbugwe, et K.K.M. Fiaboe. 2020. Effects of traditional processing techniques on the nutritional and microbiological quality of four edible insect species used for food and feed in East Africa [Effets des techniques de transformation traditionnelles sur la qualité nutritionnelle et microbiologique de quatre espèces d’insectes comestibles utilisées pour l’alimentation humaine et animale en Afrique de l’Est]. Foods 9:574 doi:10.3390/foods9050574.
Palma, L. J. Fernandez-Bayo, D. Niemeier, M. Pitesky, et J.S. VanderGheynst. 2019. Managing high fiber food waste for the cultivation of black soldier fly larvae [Gestion des déchets alimentaires riches en fibres pour la culture des larves de mouches soldats noires]. NPJ Science of Food 3:15 doi:10.1038/s41538-019-0047-7.
Parodi, A., W. J.J. Gerrits, J. J.A. Van Loon, I. J.M. De Boer, A. J.A. Aarnink, H., et H.E. Van Zanten. 2021. Black soldier fly reared on pig manure: bioconversion efficiencies, nutrients in the residual material, greenhouse gas and ammonia emissions [La mouche soldat noire élevée sur du lisier de porc : efficacités de bioconversion, éléments nutritifs dans les matières résiduelles, émissions de gaz à effet de serre et d’ammoniac]. Waste Management. Vol. 126:674-683.
Rehman, K. ur, C. Hollah, K. Wiesotzki, R. ur Rehman, A. Ur Rehman, J. Zhang, L. Zheng, T. Nieaber, V. Heinz, et K. Aganovic. 2022. Black Soldier Fly, Hermetia illucens as a potential innovative and environmentally friendly tool for organic waste management: a mini-review [La mouche soldat noire, Hermetia illucens comme outil potentiellement innovant et respectueux de l’environnement pour la gestion des déchets organiques : mini-revue]. Waste Management & Research: The Journal for a Sustainable Circular Economy 41(1):81-97.
Romano, N., A. Powell, S. Islam, H. Fischer, N. Renukdas, A. Kumar Sinha, et S. Francis. 2022. Supplementing aquaponics with black soldier fly (Hermetia illucens) larvae frass tea: Effects on the production and composition of sweet potato slips and sweet banana peppers [Complément de l’aquaponie avec du thé d’excréments de larves de mouche soldat noire (Hermetia illucens): effets sur la production et la composition des boutures de patates douces et des piments bananes doux]. Aquaculture. Vol. 555:738160.
Ruhnke I., C. Normant, D.L.M. Campbell, Z. Iqbal, C. Lee, G.N. Hinch, et J. Roberts. 2018. Impact of on-range choice feeding with black soldier fly larvae (Hermetia illucens) on flock performance, egg quality, and range use of free-range laying hens [Impact de l’alimentation de choix en larves de mouche soldat noire (Hermetia illucens) sur les rendements du cheptel, la qualité des œufs et l’utilisation du territoire par des poules pondeuses en liberté]. Animal Nutrition. Vol.4(4):452–460.
Sheppard, D.C., J.K. Tomberlin, J.A. Joyce, B.C. Kiser, et S.M. Sumner. 2002. Rearing methods for the black soldier fly (Diptera: Stratiomydae) [Méthodes d’élevage de la mouche soldat noire (Diptères : Stratiomydae)]. Journal of Medical Entomology 39(4):695-698.
Shishkov, O., M. Hu, C. Johnson, et D.L. Hu. 2019. Black soldier fly larvae feed by forming a fountain around food [L’alimentation en larves de mouche soldat noire par la formation d’une fontaine autour de la nourriture]. Journal of the Royal Society Interface 16(151):20180735
Soomro, A.A. M. Cai, Z.A. Laghari, L. Zheng, K. ur Rehman, X. Xiao, S. Hu, Z. Yu, et J. Zhang. 2021. Impact of heat treatment on microbiota of black soldier fly larvae reared on soybean curd residues [Impact du traitement thermique sur le microbiote des larves de mouche soldat noire élevées sur des résidus de caillé de soja]. Journal of Insects as Food and Feed 7(3):329-343.
Smil, V. 2002. Eating meat: evolution, patterns, and consequences [Consommation de viande : évolution, schémas et conséquences]. Population and Development Review 28(4):599-639.
Tomberlin, J.K., P.H. Adler, et H.M. Myers. 2009. Development of black soldier fly (Diptera: Stratiomyidae) in relation to temperatura [Développement de la mouche soldat noire (Diptera : Stratiomyidae) en fonction de la température]. Environmental Entomology 38(3):930-934.
Tomberlin, J.K., D. Craig Sheppard, et J.A. Joyce. 2002. Selected life-history traits of black soldier flies (Diptera: Stratiomyidae) reared on three artificial diets [Caractéristiques sélectionnées du cycle biologique de mouches soldats noires (Diptera: Stratiomyidae) élevées avec trois régimes artificiels]. Annals of the Entomological Society of America 95(3):379-386.
Wong, A. 2020. Black soldier fly of the Frangipani Langkawi Organic Farm [Mouche soldat noire de la ferme biologique Frangipani Langkawi]. ECHO Asia Notes 41:7-9.
Xiao, Y., W. Geng, Y. Yang, X. Wang, et X. Xu. 2020. Study on the difference of transformation of livestock and poultry feces by black soldier fly [Etude sur la différence de transformation des excréments de bétail et de volaille par la mouche soldat noire]. Série de conférences IOP: Earth and Environmental Science 450 (1): 012112.
Yakti, W., M. Müller, M. Klost, I. Mewis, D. Dannehl, et C. Ulrichs. 2023. Physical properties of substrates as a driver for Hermetia illucens (L.) (Diptera: Stratiomyidae) larvae growth [Propriétés physiques des substrats en tant que moteur de la croissance des larves de Hermetia illucens (L.) (Diptères: Stratiomyidae)]. Insects 14, 266 https://doi.org/10.3990/insects14030266.
Yildirim-Aksoy, M., R. Eljack, C. Schrimsher, et B.H. Beck. 2020. Use of dietary frass from black soldier fly larvae, Hermetia illucens, in hybrid tilapia (Nile x Mozambique, Oreocromis niloticus x O. mozambique) diets improves growth and resistance to bacterial diseases [L’utilisation de déjections alimentaires de larves de mouches soldats noires, Hermetia illucens, dans la nourriture du tilapia hybride (Nil x Mozambique, Oreocromis niloticus x O. mozambique) améliore la croissance et la résistance aux maladies bactériennes]. Aquaculture Reports. Vol. 17:100373.
Zarantoniello, M., A. Zimbelli, B. Randazzo, M. Delli Compagni, C. Truzzi, M. Antonucci, P. Riolo, N. Loreto, A. Osimani, V. Milanović, E.Giorgini, G. Cardinaletti, F. Tulli, R. Cipriani, G. Gioacchini, et I. Olivotto. 2020. Black Soldier Fly (Hermetia illucens) reared on roasted coffee by-product and Schizochytrium sp. as a sustainable terrestrial ingredient for aquafeeds production [Mouche soldat noire (Hermetia illucens) élevée sur des sous-produits de café torréfié et Schizochytrium sp. comme ingrédient terrestre durable pour la production d’aliments aquacoles]. Aquaculture 518: 734659.
Zhang, Y. X. Xiao, O. Elhag, M. Cai, L. Zheng, F. Huang, H.R. Jordan, J.K. Tomberlin, S-H Sze, Z. Yu., et J. Zhang. 2022. Hermetia illucens L. larvae-associated intestinal microbes reduce the transmission risk of zoonotic pathogens in pig manure [Les microbes intestinaux associés aux larves de Hermetia illucens L. réduisent le risque de transmission d’agents pathogènes zoonotiques dans le lisier de porc]. Microbial Biotechnology 15(10):2631-2644.
Zhao, J., K. Kawasaki, H Miyawaki, H. Hirayasu, A. Izumo, S. Iwase, K. Kasai. 2022. Egg quality and laying performance of Julia laying hens fed with black soldier fly (Hermetia illucens) larvae meal as a long-term substitute for fish meal [Qualité des œufs et rendements en ponte de poules pondeuses Julia nourries avec de la farine de larves de mouche soldat noire (Hermetia illucens) comme substitut à long terme de la farine de poisson]. Poultry Science 101(8):101986.
Zulkifli, N.F.N.M., A.Y. Seok-Kian, L.L. Seng, S. Mustafa, Y.S. Kim, et R. Shapawi. 2022. Nutritional value of black soldier fly (Hermetia illucens) larvae processed by different methods [Valeur nutritionnelle des larves de mouche soldat noire (Hermetia illucens) traitées par différentes méthodes]. PLOS One 17(2):e0263924.