VITA 1600 Bulevar de Wilson, Colección 500, Arlington, Virginia 22209 EE.UU. TEL: 703/276-1800. El facsímil: 703/243-1865 Internet: pr-info@vita.org
Understanding las Baterías ISBN: 0-86619-225-5 [C]1985, Voluntarios en la Ayuda Técnica,
PREFACE
Este papel es uno de una serie publicado por Voluntarios en Técnico La ayuda para proporcionar una introducción a específico innovador las tecnologías de interés a las personas en los países en desarrollo. Se piensa que los papeles son usados como las pautas para ayudar las personas escogen tecnologías que son conveniente a sus situaciones. No se piensa que ellos proporcionan construcción o aplicación se instan a las Personas de details. que avisen VITA o una organización similar para la información extensa y soporte técnica si ellos hallazgo que una tecnología particular parece satisfacer sus necesidades.
Los papeles en las series eran escrito, repasaron, e ilustraron casi completamente por VITA Volunteer los expertos técnicos en un puramente basis. voluntario Unos 500 voluntarios estaban envueltos en la producción de los primeros 100 títulos emitidos, mientras contribuyendo aproximadamente 5,000 horas de su time. el personal de VITA incluyó María Giannuzzi como editor, Suzanne Brooks que se ocupa dado la composición y diseńo, y Margaret Crouch como gerente del proyecto.
El autor de este papel, VITA Horace McCracken Voluntario, es el presidente del McCracken la Compańía Solar en Alturas, California. El coautor, VITA Joël Gordes Voluntario, es actualmente el solar diseńe a analista para el Estado de la Hipoteca Solar de Connecticut El Subsidio Program. Los críticos también son VITA volunteers. Daniel Dunham ha hecho consultando en las fuentes solares y alternativas de la energía para VITA y AID. Él ha vivido y ha trabajado en India, Pakistán, y Morocco. Sr. Dunham también ha preparado un innovador inspeccione en los destiladores solares para la AYUDA. Jacques Le Normand es Assistant El Director en el Instituto de Investigación de Abrazadera, Quebec, Canadá, qué investiga en la energía renovable. Él ha dirigido el trabajo con los coleccionistas solares y ha escrito varios publiations adelante solar y energía del viento, y conservación. Darrell G. Phippen es un el ingeniero mecánico y especialista de desarrollo con que trabajan La comida para el Hambriento en Scottsdale, Arizona.
VITA es un privado, empresa no ganancial que apoya a las personas trabajando en los problemas técnicos en los países en desarrollo. las ofertas de VITA la información y ayuda apuntaron a ayudar a los individuos y los grupos para seleccionar y las tecnologías del instrumento destinan a su situations. VITA mantiene un Servicio de la Pregunta internacional, un el centro de la documentación especializado, y una lista informatizada de los consultores técnicos voluntarios; maneja los proyectos del campo a largo plazo; y publica una variedad de manuales técnicos y papeles.
I. LA INTRODUCCIÓN DE
Las baterías han estado en el uso durante muchos ańos, pero hay hoy un la demanda mayor para el poder de la batería que en la vida antes de. que Esto renovó el interés no sólo se ha provocado por los nuevos desarrollos pero también por la diversidad de usos para las baterías en el paisano, industrial, y las aplicaciones militares.
Este papel proporciona un entendiendo básico de baterías y rastros su desarrollo de los tempranos 1800s a la Investigación de day. presente y el desarrollo continúa en un esfuerzo para resolver el inherente la debilidad de baterías, a saber, cómo condensar más energía en un paquete menor.
Una célula eléctrica o la batería es un dispositivo que transforma el la energía química contuvo directamente dentro de sus materiales activos en la energía eléctrica por medio de una reacción electroquímica. Este tipo de reacción involucra el traslado de electrones de uno el material a otra a través de una solución dirigiendo. Historically, las baterías jugaron un papel importante en los días tempranos de eléctrico el desarrollo ambos en los Estados Unidos y en Europa.
En 1800 un científico italiano nombrado que Volta descubrió eso por los dos conductores disímil sumergiendo en una solución química un la fuerza electromotriz (EMF) o el voltaje se estableció entre el dos conductors. Figure 1 ilustra una célula Voltaica simple.
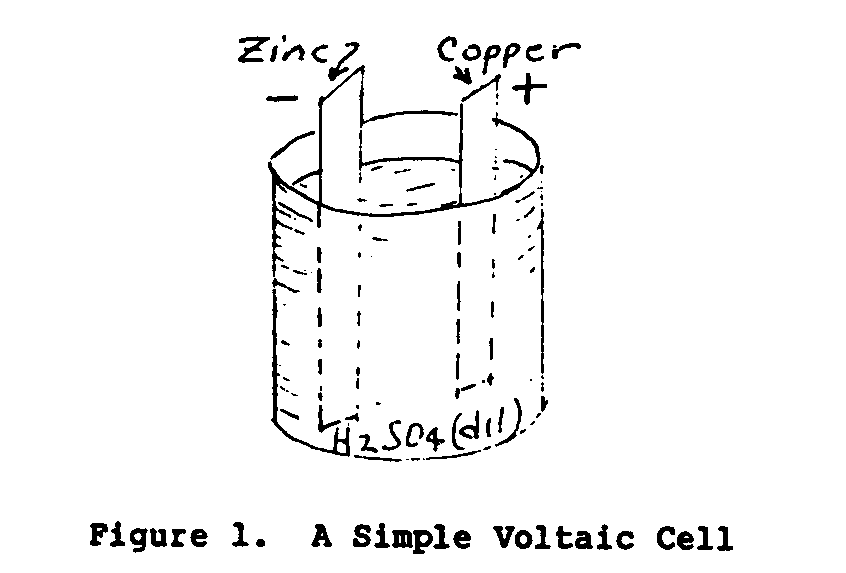
Se llaman los conductores sólidos de la célula los electrodos y el el líquido dirigiendo el electrólito. que UNA célula consiste en dos electrodos y una batería A de electrolyte. consiste en uno o más cells. El voltaje de la célula depende en el material del los electrodos y el electrólito. El rendimiento de la corriente eléctrica y el poder de la célula es dependiente en las dimensiones del plato y el peso del material del electrodo.
Hay dos tipos generales de baterías en el uso hoy: el primero tipo o " pila seca " y el almacenamiento secundario battery. UN la batería primaria produce una corriente por el acción de la descarga cuando uno de los electrodos de la célula se descompone durante el uso. Este tipo de célula usar de nuevo recargando no pueden restaurarse y el la célula entera debe desecharse cuando no es ningún active. Secondary más largo las células, por otro lado, son químicamente reversibles y lata se cobre y descargó durante muchos ciclos de funcionamiento antes reemplazándose.
En la célula de voltaje simple mostrada en Figura 2, cuando dos disímil
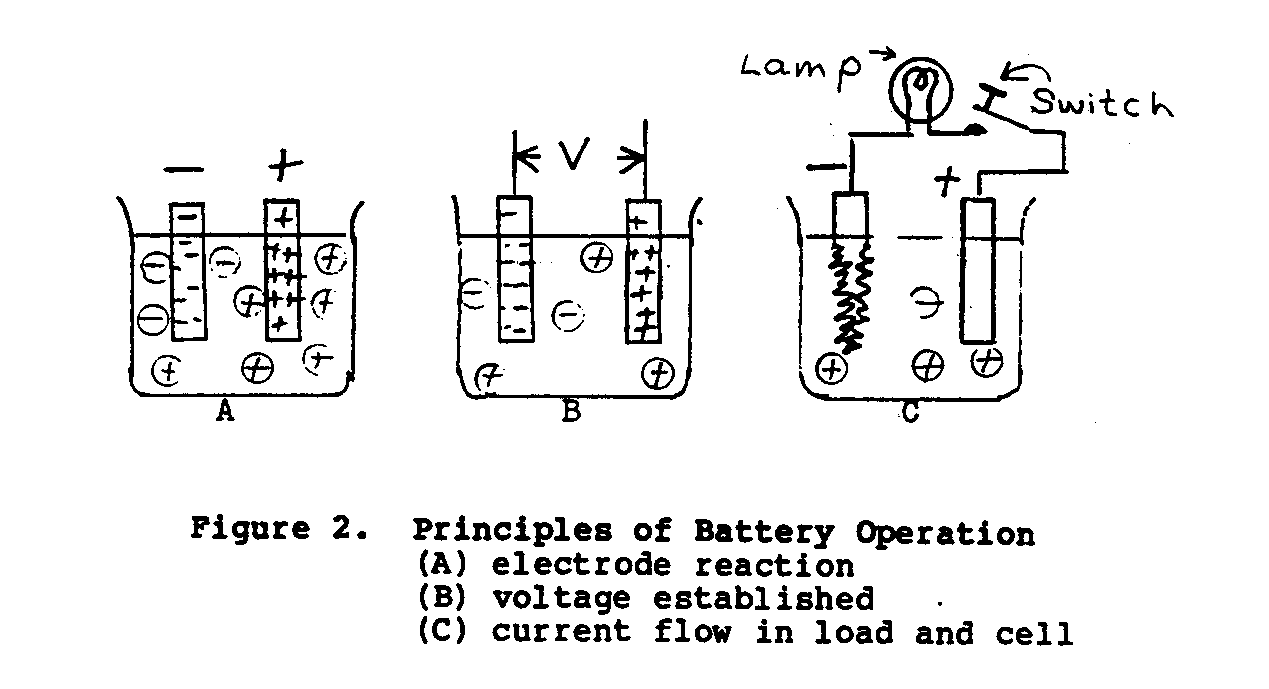
metales, cinc y cobre, están suspendidos en un electrólito de diluya el ácido sulfúrico, un potencial de approxiamtely 1.10 voltios exista entre los electrodos. que El electrodo de cinc será negativo y el electrodo cobrizo será positivo. Cuando el cambie en el circuito de carga externo está cerrado, un testamento actual, fluya a través de la carga (el dispositivo absorbente de energía) y batería en el acuerdo a la Ley de Ohm. (*) Como la corriente de carga continúa fluyendo, el hidrógeno como las burbujas aparecerá y cubrirá la hoja de cobre, y la hoja de cinc disolverá gradualmente. La desventaja principal con esta célula es que las burbujas de gas aumentan el interior la resistencia de la célula, causando el rendimiento actual para disminuir.
() La corriente directa que fluye en un circuito eléctrico es directamente proporcional al voltaje aplicado al circuito. La constante de proporcionalidad R, llamó la resistencia eléctrica, se da por el V de la ecuación = RI en que " el V " es el voltaje aplicado y Yo " soy la corriente.
II. LAS VARIACIONES DE TECNOLOGÍA
LAS BATERÍAS PRIMARIAS
Varios tipos diferentes de primero-tipo mojaron se desarrollaron las células y usó en los Estados Unidos. Most notable entre éstos era el la célula de gravedad, la célula de óxido de cáustico-cobre, los aire-despolarizamos, la célula, y la célula de Lelanche. Cada célula tenía su propio operando las características, y las capacidades actuales fueron de menos de uno el amperio (el amperio) para la célula de Lelanche a varios cientos amperios para la célula de óxido de cáustico-cobre. que El Office del Poste británico desarrolló una célula húmeda conocido como la célula del Daniel que ofreció varios los rasgos que opera excelentes.
Había dos dificultades principales con la célula del primero-tipo la construcción, la deterioración por el acción local y polarización de la célula. El acción local es un acción químico interior inherente a las baterías; la vida de la célula se disminuye gradualmente incluso aunque ninguna carga se conecta a sus términos. que el acción Local es definido como la descarga de material activo de cualquier plato debido a un poco de impureza en el electrólito o material del plato. Esto el acción causa la formación de células puestas en cortocircuito que causan el metal para deteriorar.
La polarización celular se causa por burbujas de hidrógeno que se depositan en el cátodo cuando los flujos de corriente a través de la célula. que Esto baja la tensión en los bordes y aumentos la resistencia interna del battery. los Varios métodos por neutralizar este efecto polarizante se usó, o por químico o la construcción mecánica que llevado al desarrollo de la célula aire-despolarizada.
En la célula aire-despolarizada, el electrodo era hecho de un favorablemente la forma absorbente de carbono y estaba suspendido sobre el electrólito level. desde que el electrodo de carbón no se sumergió en el electrólito la solución, la polarización de la célula fue prevenida. En el funcionamiento, el cerco de oxígeno la superficie porosa del carbono el electrodo combina con el hidrógeno evolucionado a la superficie de el electrodo de carbón y electrólito. que el ventilación Bueno fue requerido para mantener un reabastecimiento por aire satisfactorio para el funcionamiento. El La Edison carbono célula y la batería de Carbonaire eran representativas del tipo aire-despolarizado. Wet que las células del primero-tipo tienen grandemente se reemplazado por la batería de almacenamiento de secundario-tipo.
La pila seca del día " moderna " que se desarrolló por Georges Lelanche en 1868, es una modificación del Lelanche viejo mojó la célula. La diferencia es eso sólo agua suficiente se agrega al el electrólito para humedecer un forro absorbente. La pila seca moderna es principalmente los el más ampliamente usamos de todas las baterías primarias hoy debido a su cost bajo, la actuación fiable, y extendido las availability. pila seca baterías son hecho en las valuaciones de 1.5, 3, 6, 7.5, 9, 22.5, 45, 67, y 90 voltios.
El tipo más común de construcción para una pila seca se muestra en Figure 3.

La célula en la Figura 3 usos una vara del carbono para el ánodo o positivo el término y un recipiente de cinc externo (el caso) para el negativo terminal. El caso de cinc tiene un forro interno de papel absorbente material que es saturado con el electrólito. El espacio entre los electrodos está lleno con una mezcla de cok aplastado, la mena de manganeso, y grafito. El Manganeso de se agrega como un depolarizer. El electrólito es salammonic y cloruro de zinc. El la cima del caso se sella con un mastique para tapar y el cinc el recipiente es adjunto en un recipiente del papel. El voltaje de un nuevo la pila seca es 1.4 a 1.6 voltios.
Las baterías de la pila seca entran en tres clases generales: (1) la linterna eléctrica las baterías normalmente 1-1/4 pulgada en el diámetro y 2-1/2 pulgadas alto con una capacidad actual de aproximadamente 3 amperio-horas; (2) el tamańo grande las células, más normalmente llamado el Número 6 pila seca, aproximadamente, 2-1/2 pulgadas en el diámetro y 6 pulgadas alto con un la valuación actual de aproximadamente 30 amperio-horas; y (3) el " trabajo pesado " y el voltaje alto teclea que podría ser una célula o una combinación de células, usó en el servicio industrial con las capacidades actuales de 50 amperio-horas o greater. La capacidad de la amperio-hora es el rate de descargue una batería puede mantener para un periodo dado de tiempo, normalmente ocho hours. por ejemplo, una 30 batería de rated de amperio-hora normalmente pueda proporcionar aproximadamente 3-1/2 amperios durante ocho horas. Como ordinariamente usado, sin embargo, las pilas seca proporcionan menos de su valuación. La duración de almacenado está limitada por el acción local y por esa razón algunos fabricantes estampan una fecha de servicio adelante el revestimiento exterior de cada cell. el acción Local causa la deterioración eventual del la batería, y más atrás aproximadamente un o dos almacenamiento de los ańos, la batería, se vuelve useless. desde que el electrodo de cinc forma la parte del exterior la pared, su destrucción gradual debilita la estructura celular, y como las figuras del gas hidrógeno desarrolladas a la presión interior en campana, puede la ruptura y cuenta sus volúmenes corrosivos. Por esta razón, equipo nunca debe guardarse con las pilas seca encima de los periodo largos de las pilas seca de time. no requieren ningún mantenimiento y cuando ellos ningún más largo opere se desecha y reemplazó.
Un más reciente tipo de pila seca desarrollado es el Ruben o Mercurio la célula (Figura 4) . por que Esta célula se desarrolló durante el Segunda Guerra Mundial
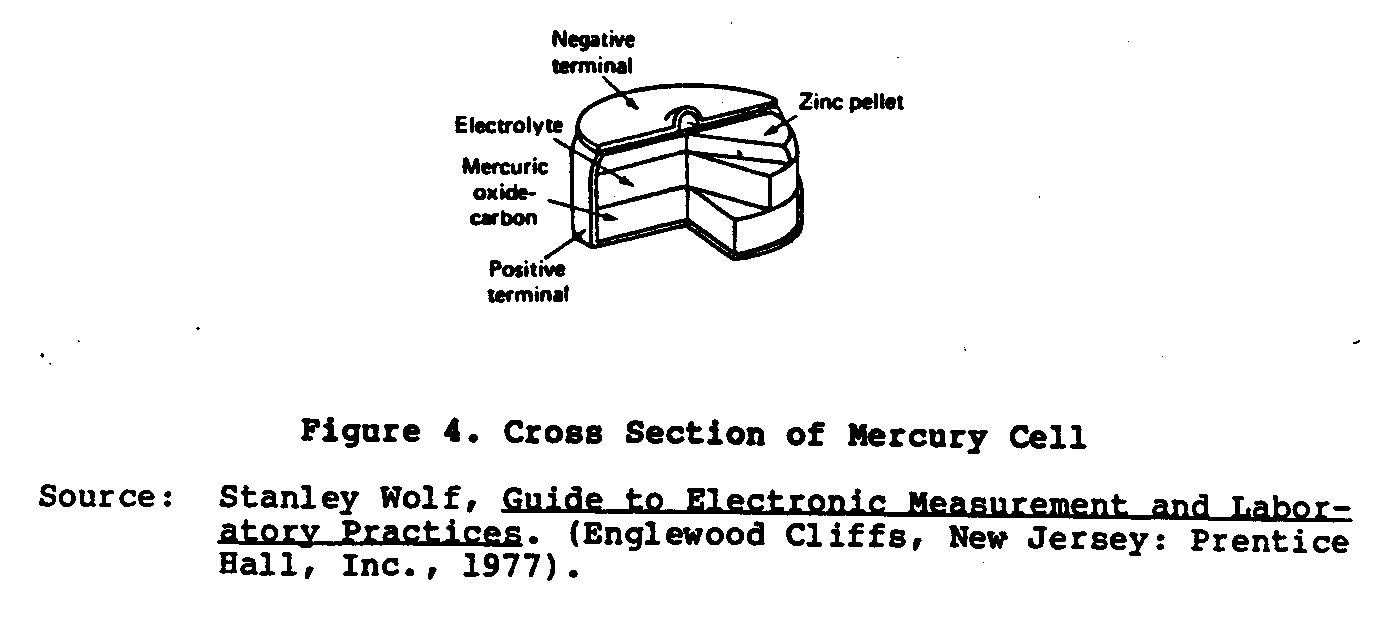
Los Laboratorios de Ruben y P.R. La Compańía de Mallory por operar pequeńo equipo electrónico que requiere el poder actual alto. que Esta célula es hecho en dos formas: el " ánodo " del rollo y el " botón teclean. " El el ánodo se amalgama cinc y el cátodo es un óxido mercúrico el material despolarizado mezcló con grafito. El electrólito es un la solución de hidróxido de potasio (el KOH) conteniendo el zincate de potasio. Estas células son lejos superiores al Lelanche pila seca deber a su tamańo compacto, la característica de voltaje llana, y muy mucho tiempo el estante life. El voltaje de ningún-carga de estas células es 1.34 voltios.
Varios desarrollos avanzados han sido hecho en las baterías pequeńas, primero y células del secundario-tipo que incluyen el el magnesio, alcalino, plata-cinc, y litio. La Mesa de 1 listas el

las características y aplicaciones de estas células.
LAS BATERÍAS DEL ALMACENAMIENTO SECUNDARIAS
Desde 1965, allí se ha renovado el interés usando el almacenamiento las baterías en el poder systems. que Esto es porque el consumo máximo moderno involucra demandas de carga muy desiguales y la carga máxima creciente demands. Cuando un system debe entregar más poder (el aumento en la carga la demanda), el proveedor puede encontrarse la demanda por cualquiera cambiando un generador adicional hacia el system o cambiando un cobró el banco de la batería hacia el line. El último requiere un muy menor la inversión.
El reavivamiento de baterías como las unidades de system de poder tiene principalmente empezado con el systems independiente pequeńo como el viento - o agua-manejado generators. En el tal systems, las baterías del almacenamiento realizan dos functions. First importantes, durante los periodo de demanda de carga baja, la batería del system puede guardar mucha de la energía generada, qué se perdería por otra parte al system. Second, la energía, guardado durante el periodo debajo del máximo está disponible durante tiempos de la carga máxima demand. La importancia del último puede ilustrarse con lo siguiente ejemplo cuantitativo: Suponga el la capacidad de la batería tiene un rate de poder de descarga igualar a la mitad de la capacidad de poder de generador ([P.sub.B] = 0.5 [P.sub.G]) . Esto significa eso bajo las condiciones normales, durante los periodo de demanda de carga alta, el el generador-batería la lata combinatoria durante varias horas sirve una carga de a a 1.5 veces eso que el generador solo podría servir.
Otra razón para el interés aumentado en el almacenamiento secundario las baterías son la necesidad por el poder del apoyo por algunos del más nuevo technology. por ejemplo, más más de las computadoras modernas involucre alguna forma de " almacenamiento volátil " de información, eso es, la información es perdió si el poder es removed. para guardar contra esta posibilidad, muchos, los systems de computación usan " el systems de poder continuo ", basado en las baterías del almacenamiento, proporcionar la corriente eléctrica a la computadora, el equipo cuando el poder comercial está perdido.
La batería del almacenamiento, construida con las células húmedas secundarias, es similar en el acción a una célula primaria, exceptúe los acción químicos involucrado es prácticamente completamente reversible. Once que la célula es descargado, actual de una fuente externa, atravesó el la célula en la dirección opuesta, restaurará substancialmente el la batería a su original cobró la condición.
Hay tres tipos de baterías del almacenamiento actualmente disponible: (1) el tipo del llevar-ácido; (2) el ferro-níquel o la batería alcalina (La célula de Edison); y (3) el níquel-cadmio o álcali-tipo (Nicad).
Las Baterías del llevar-ácido
La batería del llevar-ácido es el tipo ampliamente usado de batería hoy debido a su cost bajo, fiabilidad, la actuación buena, las características, y la aplicación ancha. Esta batería es manufacturada en muchos tamańos y capacidades la 1 amperio-hora comprendido entre a a varios mil valuación de las amperio-horas.
El almacenamiento celular usa la primacía de la esponja reactiva para el negativo el electrodo (Pb), lleve el dióxido para el electrodo positivo (Pb0), y diluye el ácido sulfúrico para el electrólito. El electrodo los materiales tienen la fuerza estructural pequeńa y deben apoyarse en platos o grids. La reja del placa de batería tiene dos funciones: primero, apoya el material del plato activo; y segundo, sirve como un conductor conectar el término del plato a todos las partes del material activo.
Lleve los placas de una batería son divididos en dos tipos, el Plante (formó) y el Faure (pegó), así desplegado en Figura 5. En
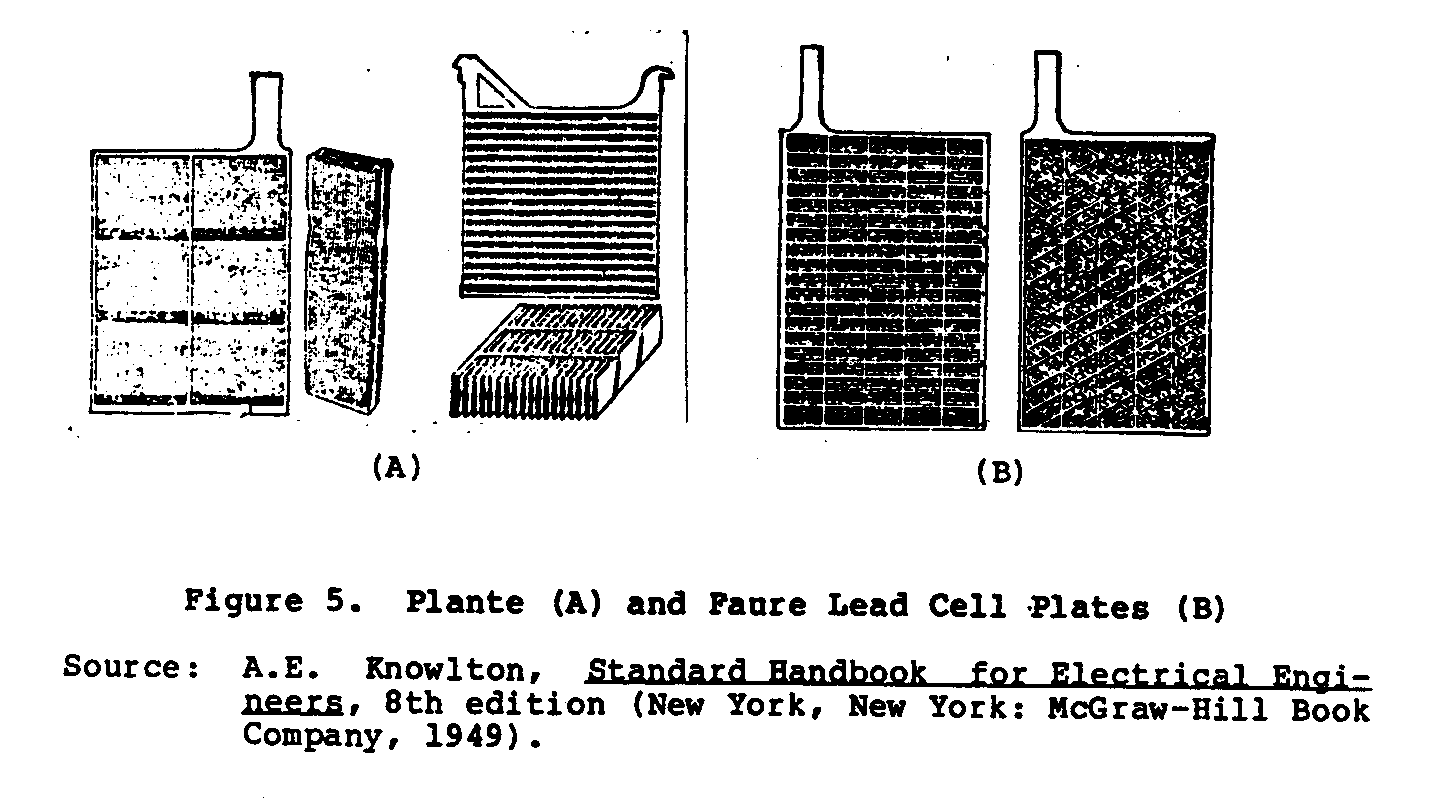
el Plante-tipo de construcción que el material activo es eléctricamente formado de pura primacía por un proceso electroquímico del la primacía metálica de la reja de apoyo. En el Faure-tipo el el material activo se aplica a la reja de apoyo en la forma de un follwed de pasta por una escena, secado, y funcionamiento de la creación.
Figure 5 muestras el Plante (UN) y Faure (el B) lleve plates. celular El se soldan las asambleas celulares juntos para formar positivo y negativo grupos que se entrelazan para hacer a juntos el completo batería que se ponen los Separadores de cell. entre los electrodos, y el elemento completo se pone en un recipiente y sealed. El el uso de platos grandes con cerca límites del espacio la resistencia interna de la batería a un nivel bajo. Figure 6 muestras un chaqué

la vista de la célula de almacenamiento de primacía.
Durante la descarga el material de la batería de ambos platos es reconstruido en la primacía sulfate. La cantidad de sulfato de plomo formó los platos del onthe y la cantidad de ácido perdió del electrólito es en exacto proporcione al rate de descarga. Las tomas de acción inversas el lugar cuando la célula se cobra. que las reacciones química Celulares son representado por lo siguiente ecuación; sin embargo, esto es un la forma simplificada como el acción real es mucho más complicada.
* La valuación de amperio-hora de batería es normalmente basada en una descarga de la 8-hora el rate.
Al placa positiva:
PB[O.SUB.2] + HS[O.SUB.4][SUP. -] + [3H.SUP.+] + 2E.SUP. ------> PB[SO.SUB.4] + 2[H.SUB.2]O
Al placa negativa:
Pb + HS[O.sub.4][sup. -]-----> Pb[SO.sub.4] + [H.sup.+] + [2e.sup. -]
La reacción celular combinada para los dos la descarga y el cargo se expresa por lo siguiente ecuación:
descargan -------------> Pb[O.sub.2] + Pb + 2[H.sub.2] S[O.sub.4] <= == == = 2Pb[SO.sub.4] + 2[H.sub.2]O + la energía eléctrica sulfúrico el plate del plate los platos de ácidos <-------------; cobran
En la descarga el ácido separa del electrólito y formas un la combinación química con los platos, cambiándolo al sulfato de plomo. Cuando la descarga continúa, el ácido adicional es arrastrado del el electrólito hasta que actual dejará dado fluir. El agua, formó por la pérdida de ácido a los platos, baja el permaneciendo específico la gravedad (* *) del electrólito. En la práctica común, la descarga es siempre detenido antes de los platos tiene el sulfated completamente, porque una vez completamente el sulfated, la condición de la batería no puede convertirse atrás al material activo en el cargo. En el cargo el acción inverso las tomas ponen: el ácido en los platos del sulfated se maneja atrasado en el electrólito, y el S[O.sub.4] combina con el hidrógeno en el agua para formar el ácido sulfúrico adicional ([H.sub.2][SO.sub.4]).
El electrólito para las células del llevar-ácido es diluir acid. sulfúrico Para un batería totalmente cobrada a que el peso especifico varía de 1.200 1.30 y cuando descargó 1.150 (el agua pura mide 1.00) . El el peso especifico es moderado por un hidrómetro del jeringa-tipo como mostrado en Figura 7, y los valor son temperatura corregida.
* El símbolo e - las posiciones para los electrones.
* * El peso especifico se define como la proporción en peso de un dado el volumen de una substancia a un volumen igual de agua pura. El voltaje de una célula de primacía está aproximadamente 2.10 voltios en ninguna carga pero es superior al cobrarse. el voltaje Normal en el cargo es 2.15 voltios y cuando los acercamientos celulares el cargo lleno este valor rápidamente los aumentos a entre 2.5 y 2.6 voltios. Este intervalo posterior de cargo está conocido como el " periodo " del gassing. Gassing del el electrólito a cuando quiera durante cobrar debe evitarse como el el rate de cargo también es totalmente high. Como un alcances celulares su examen final la condición cobrada, una corriente alta no es aconsejable como este exceso la corriente descompone el agua en el electrólito que se maneja fuera de en la forma de gas.
La batería del llevar-ácido tiene varias desventajas: (1) las células son la temperatura sensible y pierde el poder en las temperaturas frías; (2) los platos celulares tienden abrochar y torcer adelante sostuvo, la corriente alta repare, y (3) el cuidado especial debe observarse cuando una batería es no usado para los periodo largos, por otra parte las células legan el sulfato.
Las Baterías del ferro-níquel
El ferro-níquel o la batería alcalina fueron desarrolladas para superar el las desventajas inherentes de la célula del llevar-plato. es un radical la salida de él en construcción y funcionamiento. En el Estados Unidos que esta batería está conocido como la " célula de Edison, " nombró más atrás su inventor Thomas Ŕ. Edison. Figure 8 muestras la construcción

de un cell. típico El placa positiva consiste en acero tubos que contienen hidrato de níquel y níquel agregaron en el alternante layers. El placa negativa se forma de cajas de acero llanas o bolsillos que son performado y condensaron con los gránulos del óxido de hierro. Las rejas de Sheet-steel apoyan estos tubos y bolsillos que son echado el cerrojo a para formar la Célula de groups. celular positiva y negativa juntos los términos y el recipiente de acero son niquelados. los separadores Todo y las partes aislantes son hecho de caucho. Los usos celulares un el electrólito de 21 solución percentual de hidróxido de potasio que contiene un la cantidad pequeńa de hidrato del litio.
La química de esta célula es bastante complicada, y el químico reacción que ocurre dentro de la célula es completamente diferente de el de la primacía cell. que El electrólito actúa meramente como un dirigir el medio y no entra en la combinación con cualquiera del el material del plato activo durante el funcionamiento. Su peso especifico los restos prácticamente constante durante el ciclo completo de cargo y discharge. Condition de cargo de la batería o descarga es determinado por un voltímetro que lee y no por el peso especifico de el electrolyte. que La reacción del vaso de la batería alcalina es:
descargan ------------------>
[Fe.sub.2] + 2NiOOH + el KOH + 2[H.sub.2]O-------> [Fe.sub.2][(OH) .sub.2] + 2Ni[(OH) .sub.2] + el KOH + eléctrico <------;
<-----------------; la energía de
CHARGE
El voltaje de cada célula es aproximadamente 1.50 voltios adelante abra el circuito, pero es superior en el cargo y baja bajo las condiciones de carga. Estas baterías se dan una valuación de capacidad de amperio-hora basada en su rate de descarga a a la tensión final de 1.00 por cell. Algunas valuaciones actuales son basadas en una 5-1/2-hora continuo descargue el rate, mientras otros son basados en un rate de la 3-1/2-hora.
Al contrario de la batería del llevar-célula, no hay voltaje mínimo debajo qué este tipo de célula no puede descargarse. En el hecho, esta célula puede descargarse poner a cero los voltios, puesto en cortocircuito en sus términos, y salió en esta condición para un periodo indefinido. Esto es el método por que una batería alcalina se pone en el almacenamiento.
También, esta célula puede sobrecargarse accidentalmente, cobró en el la dirección mala, y momentáneamente puso en cortocircuito sin el dańo. Las baterías alcalinas no son dańadas helando y un electrólito con un peso especifico de 1.200 a las 15.5[degrees]C (60[degrees]F) el sólido de las heladas a las -66[degrees]C (-87[degrees]F). que El electrólito de esta célula deteriora gradualmente durante el uso y debe cambiarse en el futuro.
Las ventajas principales de la célula del ferro-níquel son: (1) es sumamente la luz y debiendo muy bien a su construcción de acero; (2) ofrece una vida indefinidamente larga; y (3) supera el el problema del sulfating celular de la batería del llevar-ácido. El jefe la desventaja es su alto primero el cost y la resistencia interna alta.
Las baterías de níquel-cadmio
Níquel-cadmio o baterías de Nicad, una relativamente nueva suma a las células del almacenamiento, se desarrolló en Europa. que Estas baterías consisten de asambleas entrelazadas de positivo y montado de los placas negativa en un recipiente de acero sellado. El material activo positivo, níquel, el hidróxido, y el material activo negativo, el óxido del cadmio, es encajonado en los bolsillos de acero idénticos, finamente perforados. Los platos es hecho a de filas de estos bolsillos que se rizan y formado en acero frames. Positive y asambleas del placa negativa es juntos empernado a las barras de autobús de acero pesadas. Los grupos de discos de son entrelazado y separó por las varas plásticas delgadas. La célula eléctrico los términos y caso son niquelados. El electrólito es un la solución de especialmente hidróxido de potasio purificado (el hidróxido de potasio) disuelto en el agua destilada. Figure 9 muestras una vista transversal
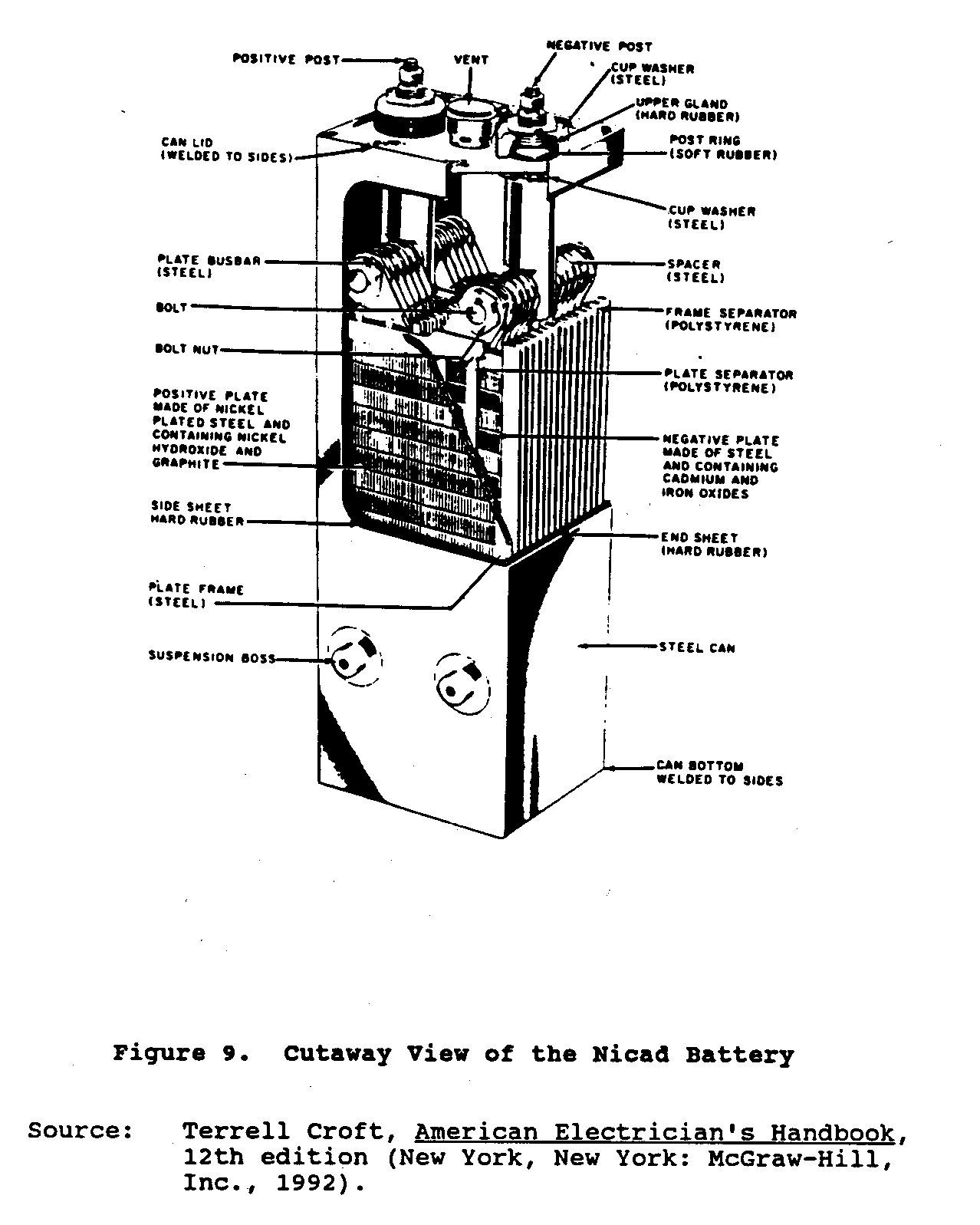
de la batería de Nicad.
La reacción celular simplificada es:
cobran <-------------------;
Cd + 2NIOOH + el KOH + 2[H.sub.2]O------> Cd[(OH) .sub.2] + 2Ni[(OH) .sub.2] + el KOH + eléctrico <------la; energía de
-------------------->
descargan
Durante cargo o descarga de la célula, hay prácticamente no cambie en el peso especifico del electrólito. Like el La célula de Edison, la sola función del electrólito es actuar como un conductor para el traslado de iones de hidrógeno de un electrodo a el other. La valuación de voltaje de cada célula es 1.20 voltios adelante abra el circuito; cuando conectó a una carga externa, este voltaje permanece justamente constante a a aproximadamente 90 por ciento de su rated capacity. La valuación de la amperio-hora de las células de Nicad es basada en un el voltaje de la descarga final de 1.10 voltios por la célula. Edison Diferente las células, las baterías de Nicad serán dańadas el encima de-descargando repetido debajo de su valuación celular mínima de 1.10 voltios. las baterías de Nicad tenga un régimen de funcionamiento de temperatura de -51[degrees]C (-60[degrees]F) a 93[degrees]C (200[degrees]F).
Las baterías de Nicad son vibración y susto la deuda resistente a su la construcción de acero; el sostenimiento su cargo bien durante largo ocioso los periodo; mantenga una fuente de voltaje constante durante la descarga; y no se dańa por la sobrecarga. en que Estas baterías pueden montarse cualquier posición en discharge. Como la célula de Edison, la batería de Nicad tiene un alto primero el cost como comparado con la batería del llevar-ácido; sin embargo, este cost alto se compensa por su vida más larga span. UNA comparación de llevar-ácido, el alcalino, y las baterías de Nicad son presentado en Mesa 2.
Mesa 2. La comparación de Llevar-ácido, el Ferro-níquel, y baterías de níquel-cadmio
Operating la Vida Celular La Typical Temperatura la Energía de el Cargo de / El Cell Rango la Densidad de Discharge Cost TYPE VOLTAGE ([EL DEGREES]C) (WH (*) /KG) (CYCLES) ($/WH (*))
Llevar-Acid 2.0 20 a 30 37 1200-1500 .08 Níquel-Iron 1.2 2.2 a 46 29 Níquel-Cadmium 1.25 (-51) a 93 33
* Watt-horas
Los Procedimientos de Mantenimiento Generales para las Baterías del Almacenamiento
El mantenimiento apropiado es esencial para el servicio sin preocupaciones continuado de almacenamiento batteries. Mientras la construcción celular es diferente para los varios tipos, el mantenimiento es similar para todos los tipos y consiste en lo siguiente procedimientos generales:
1. Keep las células limpian y seco;
2. Check el nivel de electrólito regularmente;
3. Keep las baterías cobraron en todo momento; y
4. Keep las impurezas de todos los tipos fuera de células cuando ellos quieren tienen un efecto dańoso y en el futuro la ruina them. Never usan cualquier herramienta o utensilios (los hidrómetros, los embudos, etc.) que se ha usado para reparar otros electrólitos diferente de eso requerido para esa batería específica, sobre todo las herramientas usaron para las baterías del llevar-ácido.
5. Refer a las recomendaciones de fabricantes y guarda un el registro de mantenimiento escrito.
El electrólito de la célula del llevar-ácido nunca requiere el reemplazo salvo la pérdida debido a los derramamientos accidentales. However, en el Edison, y células de Nicad hay una deterioración gradual de su electrólito, qué debe reemplazarse en el futuro encima de la vida del la batería.
BIBLIOGRAPHY/SUGGESTED READING LA LISTA
BAUMEISTER, T., EL ED. El Mark Norma Manual para los ingenieros mecánicos. 7 Edición. Nueva York, Nueva York,: El Libro del McGraw-colina La Compańía de , 1967.
CARR, C.C. El Electricista americano de destreza el Manual. 8 Edición. Nueva York, Nueva York,: La Compańía de Libro de McGraw-colina, 1961.
Fink y Batey. Norma Manual para los ingenieros eléctricos. 11 La Edición de . Nueva York, Nueva York,: La Compańía de Libro de McGraw-colina, 1978.
Hubert, Charles I. Preventative el Mantenimiento de Equipo Eléctrico. Nueva York, Nueva York,: La Compańía de Libro de McGraw-colina, 1969.
Knowlton, A.E., Manual de la Norma para los ingenieros eléctricos. 8 La Edición de . Nueva York, Nueva York,: La Compańía de Libro de McGraw-colina, 1949.
La Enciclopedia del McGraw-colina de ciencia y tecnología. 5 Edición. Nueva York, Nueva York,: La Compańía de Libro de McGraw-colina, 1982.
El timbre y Principios de Bush. de Ingeniería Eléctrica. 3 Edición. Nueva York, Nueva York,: Wiley e Hijos, Inc., 1946.
El lobo, Stanley. Guide a la Medida Electrónica y Laboratorio, Practices. Los Precipicios de Englewood, New Jersey,: El Vestíbulo de Prentice, Inc., 1977.